Довольно большую долю массы сухого мицелия грибов составляет их клеточная стенка, а именно ох 5 до 15%. Состав ее сильно варьирует и часто весьма специфичен для определенных таксономических групп грибов. Это можно видеть tt3 примеров ее состава у представителей дрожжей, хитридиевых и мукоровых грибов — зигомицетов, приведенного в табл. 1.3 (Aronson, 1965).
|
Таблица 1.3 Химический состав клеточной стенкн грибов в % от сухого веса их оболочки (Aronson, 1965)
|
|
* Количество золы без фосфатов. |
Структурно оболочки грибов построены на основе двухфазной системы, в которой имеются микрофибриллы, включенные в аморфную массу матрикса. По данным электронной микроскопии, она состоит не менее чем из двух слоев с различно направленной ориентацией фибрилл. Внутренний слой обычно ориентирован по главной оси клетки, наружные—под углом к ней (рис. 1.1).
|
|
||
|
|||
|
|||
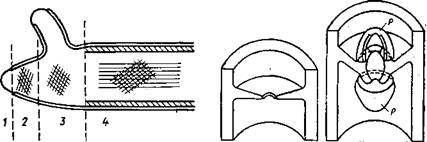
сусцепции, проникновение микрофибрилл; 3 — область продольного растяжения фибрилл (область расслабления); 4 — область формирования внутреннего слоя жестких продольных фибрилл (область ригидификации и прекращения развития наружной сети фибрилл) (Burnett, 1968)
У дрожжей оболочка обычно многослойная, причем в наружном толстом слое локализован маннан, во внутреннем тонком — глю — кан. У водных грибов, например у Allomyces, оболочка образует ложные перегородки — псевдосепты, напоминающие спицы колеса. У сумчатых и базидиальных грибов наблюдаются настоящие перегородки— септы. У сумчатых септы между клетками обычно имеют одну простую пору, по обе стороны которой в процессе ее формирования можно видеть по паре осмофильных телец Воронина. У базидиальных грибов эти поры нередко бывают очень сложными, снабженными колпачками — парентосомами (рис. 1.2). Такие поры были найдены в плодовых телах и ризоморфах ряда высших базидиомицетов (Moore, 1965; Burnett, 1968). Однако до настоящего времени остается не вполне ясным, относить ли это различие в структуре септальных пор аско — и базидиомицетов к их таксономической принадлежности или к гаплоидной и гомокариотической структуре генома сумчатых и к ди — и гетерокариотической природе базидиальных грибов. Таких исследований пока еще нет, но их
значение для эволюционных и таксономических построений в царстве грибов весьма принципиальное.
Много нового добавили к изучению септальных пор грибов исследования на электронно-микроскопическом уровне (Flegler et al., 1976; Камалетдинова, Васильев, 1982). Во-первых, стало известно, что долипоры базидиальных грибов являются структурами, видимо, герметически изолирующими клетки мицелия друг от друга вплоть до начала образования ими плодовых тел (Flegler et al., 1976). Эта изоляция осуществляется растворяемыми про — теолитическими ферментами и одновременно осмофильными (содержащими белки и липиды) двусторонними пробками, которые исчезают к моменту формирования плодовых тел. Их исчезновение сопровождается перфорациями парентосом и сообщение между клетками гиф восстанавливается.
Последние наблюдения над септами в плодовых телах диско — мицетов (например, Peziza badia — Камалетдинова, Васильев, 1982) показали, что сходные разобщающие клетки гиф структуры существуют и у класса сумчатых грибов. В их формировании принимают участие тельца Воронина, образующиеся в колбообразных инвагинациях клеточной мембраны, осмофильное содержимое которых (тельце Воронина) высвобождается близ септы и располагается у отверстия септы, постепенно проникая в нее, создавая при этом замыкающее ее устройство. Дальнейшему проникновению тельца Воронина в вышележащий гимениальный слой, видимо, препятствует специальная перфорированная структура, лежащая над порой септы в материнской клетке будущей сумки, которая оказывается полностью изолированной от проникновения субмик — роскопических органелл из субгимениального слоя. Подобные же изолирующие структуры наблюдаются и в формирующихся в плодовых телах парафизах.
Сходные структуры имеются и в спорулирующем мицелии несовершенных грибов, содержащих тельца Воронина, например у Arthrobotrys conoid. es. У продуцента пенициллина дейтеромицета Pйnicillium chrysogenum была обнаружена в септе структура, в точности соответствующая найденной Камалетдиновой и Васильевым у дискомицета Peziza badia (Kurilowich et al., 1980).
Скелетные основы оболочек грибов составлены кристаллически организованными полисахаридами: целлюлозой, хитином, хитоза — ном, маннаном, глюканами и другими. Все они имеют линейную структуру с 1,4-связями исходных компонентов — мономеров гек — соз, амино — и ацетаминогексоз. По результатам микрохимического тестирования (окраска рутениум красным) ранее считалось, что в составе клеточных оболочек грибов имеется пектин. Однако результаты химического анализа не подтвердили в ее составе входящего в структуру пектина мономера галактуроновой кислоты (Aronson, 1965).
Хитин и хитозан для большей части грибов очень характерны в составе их оболочек как азотсодержащие полимеры. При этом хитин грибов очень сходен с хитином насекомых и ракообразных, что было подтверждено картиной их дифракции в рентгеновских лучах. Однако азота в хитине грибов меньше, чем у животных, и среди его составных частей была обнаружена метилпентоза, называемая мицетозой. Хитин у грибов удается обнаружить микрохимически по методу Ван Висселинга, с помощью частичного щелочного деацетилирования и последующей реакцией на хитозан и по дифракции Х-лучей. Он не был найден только у оомицетов, таких, как сапролегниевые и пероноспоровые грибы. Ранее считалось, что хитин отсутствует у дрожжей, однако он содержится в клеточных перегородках — септах сахаромицетов (Кулаев, 1975).
В настоящее время установлено, что хитин можно обнаружить у Chitrydiales, Monoblepharidales, Protomycetales, Hyphochytridiales, у всех Endomy cet ales, Blastocladiales, Mucorales, Entomophthora — les, y всех сумчатых и базидиальных грибов и происходящих от них Fungi imperfecti (дейтеромицетов). Исключение составляют Oomycetes, у которых из полисахаридов в оболочке присутствует целлюлоза, полностью отсутствующая у представителей дрожжевых грибов.
В течение последнего времени в связи с выявлением возможности практического использования хитина грибов для синтеза полимеров появилось довольно много исследований с данными по более тонкому изучению его в сопоставлении с хитином ракообразных (табл. 1.4). Ацетата и D-глюкозамина меньше всего
|
Таблица 1.4 Физико-химические свойства образцов хитина микроскопических грибов и панциря краба (% от массы образца) (Феэфилэва и др., 1980)
|
у Aspergillus niger, что объясняется более высоким содержанием пентоз и глюкозы в составе ^-глюкана и двух а-глюканов оболочки гриба. Анализ дифрактограмм показал идентичную кристаллическую структуру хитина грибов и крабов с несколько большей упорядоченностью у последних. Кроме того, хитин грибов в противоположность пластинчатой структуре хитина крабов имел волокнистое строение (Феофилова и др., 1980).
Заменяющий хитин у некоторых мукоровых грибов хитозан, обнаруживаемый при слабом кислотном гидролизе реакцией на
хитозансульфат, найден, кроме Mucor rouxii, также у Phycomyces blakesleeanus. Количество ацетильных групп в нем оказалось различным и варьировало у М. rouxii до нуля. Из других аминополи — сахаридов полимер галактозамина со свободной аминогруппой, способной связывать фосфаты, со структурой типа хитозана, был выделен из клеточных оболочек Neurospora crassa, N. sitophilla, A. niger и Botrytis cinerea (Aronson, 1965). У ряда грибов встречены полимеры из аминосахаров, ассоциированных с маннаном, глюканом и протеинами.
Целлюлоза в клеточных оболочках грибов обычно не встречается одновременно с хитином. Исключение составляет один Rhizi — diomyces из порядка гифохитридиевых грибов, у которого они были обнаружены одновременно. Целлюлоза была обнаружена у грибов из оомицетов порядков Acrasiales, Lagenidiales, Sapro- legniales, Leptomitales, Peronosporales (Aronson, 1965).
Среди грибов, обитающих в водной среде, целлюлоза встречается обычно только в группах, имеющих двужгутиковые зооспоры. У Blastocladiales и Monoblepharidales, имеющих одножгутиковые зооспоры, ее нет. Исключение, которое составляет Rh. izidiom. yces из порядка Hyphochytridiales, имеющий одновременно и хитин, и целлюлозу н считающийся по Нейбл переходной формой между имеющими хптип Chytridiales и Blastocladiales и содержащими целлюлозу оомнцетами, объяснимо. Эта одножгутиковая форма имеет жгутик зооспор перистый, а не бичеподобный, как у Blastocladiales и Monoblepharidales. Любопытно, что строение ворсинок перистых жгутиков оомицетов напоминает строение жгутиков бактерий, тогда как бичеподобные полностью схожи со жгутиками флагеллат.
Целлюлоза у грибов легко обнаруживается микрохимически реактивом Шпейцера или реактивом, состоящим из раствора йода в йодистом калии с добавлением 70%-го раствора серной кислоты.
Глюканы у грибов очень обильны и отличаются от целлюлозы по их структуре. Мономеры их также представляют собой глюкозу. Однако наиболее изученные глюканы дрожжей имеют менее кристаллические структуры, чем целлюлоза. Кристалличность глюка- нов увеличивается вследствие образования гидроглюканов при их обработке серной кислотой. Подобные глюканы, находящиеся в ассоциации с протеинами, были обнаружены у дрожжей и у Pйnicillium notatun (Aronson, 1965). Другой глюкан, входящий в состав оболочек грибов,.— каллоза, сходная с обнаруживаемой в ситовидных трубках высших растений и сильно красящаяся основными красителями, т. е. имеющая кислую природу, в противоположность целлюлозе имеет Я-l,3-b1I0K03HДHbie связи. Подобный глюкан, красящийся основными красителями, был обнаружен у ScleroHnia. Глюканы имеются также у Aspergillus fischeri, Allo — myces macrogynus, Neurospora crassa. У грибов встречаются также гетерополисахариды, составленные из мономеров различных сахаров, особенно частые у рода Pйnicillium. У дрожжеподобных форм, патогенных для животных, как у Coccidioides и Cryptococcus, по
добные же, но кислые полисахариды входят в состав окружающих их клетки капсул. Примеры глюканов и других продуктов полимеризации моносахаров и сахарных кислот, входящих в состав оболочек клеток и запасных веществ грибов, приведены в табл. 1.5.
|
Полисахарид |
Продукты гидролиза |
Oprann3MM-npoflyueHTM |
|
Гликоген |
Глюкоза |
Aspergillus rtiger, Phyma- totrichum omnivorum h ДP — |
|
Склеротиоза |
» |
Pйnicillium sclerotiorum |
|
Компактоза |
» |
P. brevi-compactum |
|
Нигеран (микодекстран) |
* |
A. niger Pйnicillium sp. |
|
Полпглюкоза |
» |
A. jisekeri. P. charlesii |
|
Кислая полиглюкоза |
» |
P. luteum |
|
Капсульная полиглюко |
» |
Torulopsis sp. |
|
за |
||
|
Лютеиновая кислота |
глюкоза, малоновая кислота |
P. luteum |
|
Варианоза |
глюкоза, галактоза |
P. varians |
|
Капреолиноза |
глюкоза, манноза, галактоза, малоновая кисло- |
P. capreolinum |
|
Полиуронид |
та глюкоза, галактуроновая кислота |
Coccidioides immitis |
|
Леван |
фруктоза |
A. sidovi |
|
Полпгалактоза |
галактоза |
P. charlesii |
|
Ругулоза |
» |
P. rugulosum |
|
Микогалактан |
» |
A. niger |
|
Нейтральная полигалак |
» |
P luieum |
|
тоза |
||
|
Г глактокаролоза |
» |
P. charlesii |
|
Маннскаролоза |
манноза |
* |
|
Капсульный полисахарид |
ксилоза, манноза, глюку- |
Cryptococcus ( Torlt lopsis) |
|
роновая кислота |
neofurman s |
|
|
Капсульный полисахарид |
ксилоза |
Torulo/’sis sp. |
|
Таблица 1.5 |
|
Примеры полисахаридов грибов с расшифрованной структурой по Кокрейиу (Cochrane, 1958) |
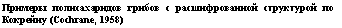 Маннаны, полисахариды, составленные из мономеров маннозы. встречаются особенно обильно у дрожжей, причем они часты у видов дрожжей, обитающих на поверхности камбиального стоя inn корой деревьев. К числу таких форм относится обитающая пт корой хвойных деревьев Hansenula; в окружающей клетки ли трожжей капсуле полисахарид присутствует в форме фосфомгш — нана. Этот гидрофильный и слизистый полисахарид прилипнет имеете с дрожжами к щетинкам, покрывающим тело жуков коро СДОВ, И таким путем дрожжи переносятся с ИХ ПОМОЩЬЮ с ОД1По дерева на другое (Wickerham, Barton, 1961). У гнфообразуюшп’: грибов маннаны пока обнаружены не были, но в гидролиза i ;i их клеточных стенок встречается манноза.
Маннаны, полисахариды, составленные из мономеров маннозы. встречаются особенно обильно у дрожжей, причем они часты у видов дрожжей, обитающих на поверхности камбиального стоя inn корой деревьев. К числу таких форм относится обитающая пт корой хвойных деревьев Hansenula; в окружающей клетки ли трожжей капсуле полисахарид присутствует в форме фосфомгш — нана. Этот гидрофильный и слизистый полисахарид прилипнет имеете с дрожжами к щетинкам, покрывающим тело жуков коро СДОВ, И таким путем дрожжи переносятся с ИХ ПОМОЩЬЮ с ОД1По дерева на другое (Wickerham, Barton, 1961). У гнфообразуюшп’: грибов маннаны пока обнаружены не были, но в гидролиза i ;i их клеточных стенок встречается манноза.
У грибов встречаются также полисахариды, содержащие галактозу, 6-дезоксипентозу, метилпентозы, наиболее часто фруктозу, особенно у мукоровых. В оболочках клеток Pйnicillium chryso — genum были найдены из числа пентоз 6-дезоксипентоза, рамноза и ксилоза, которую обнаружили также у трутовика Polystictus sanguineus.
Полисахаридно-протеиновые комплексы были обнаружены у дрожжей, например у Candida albicans — возбудителя молочницы грудных детей. Маннаново-протеиновый комплекс был найден у Saccharomyces.
Липиды у грибов количественно сильно варьируют в зависимости от условий окружающей среды и возраста культуры. Иногда их количество достигает 35—36% от массы сухого вещества клеток. У дрожжей более 3% липидов найдено в их оболочках. Обнаружены они и в оболочках мукоровых грибов, например у Мисог rouxii и Phycomyces, в спорангиеносцах которого установлено около 25% липидов от их сухой массы. Вероятно, они содержатся там в образованиях типа кутикулы (Aronson, 1965).
Пигменты также входят в заметных количествах в состав клеточных оболочек грибов. Пигменты, в особенности часто локализованный в виде особого слоя черный пигмент, меланин, очень часто встречаются в клеточных стенках мицелия или в оболочках спор многих грибов. Такой меланиновый слой имеется в оболочках аскоспор Neurospora tetrasperma (Aronson, 1965).
Меланин отсутствует у грибов с низкой активностью полифе — нолоксидазы, принимающей участие в его биосинтезе, и с преобладанием в обмене активных дегидрогеназ. Такие грибы, к которым относятся представители родов Fusarium, Trichothecium, Arthrobotris, Cephalosporium и многие другие, характеризуются чаще всего розовой или оранжевой окраской спорулирующих структур, зависящей от обилия каротиноидов, принимающих на себя роль светозащитного экрана и антиоксиданта, принадлежащую у темноокрашенных грибов меланину. Связь наличия каротиноидов с высоким уровнем активности дегидрогеназ объясняется тем, что оптимальные условия окислительно-восстановительного режима для действия дегидрогеназ совпадают с условиями, оптимальными для биосинтеза каротиноидов и других продуктов шунта терпеноидов. Каротиноидные пигменты уже не входят обычно в состав клеточных оболочек грибов, а локализуются либо в клеточной мембране, либо в каплях липидов, рассредоточенных в цитоплазме. В отдельных случаях у грибов встречаются совершенно особые пигменты, как оммохромы, глазные пигменты насекомых, у трутовика Pycnoporus (Polyporus) cinnabarinus (Шиврина, 1965) или фикобилины у видов сыроежек Russula emetica и R. paludosa (Ефименко, 1972), входящие в систему фотосинтеза у сине-зеленых и красных водорослей.
Из встречающихся в больших количествах неорганических соединений в клеточных оболочках грибов, в частности в оболочках конидий Ыеигозрога, найдено много полифосфатов, связывающих около 11% катионов оболочки и образующих в ней солеподобные соединения хитозанфосфаты. У дрожжей фосфаты связаны с глюкопротеидами, и, кроме того, в их оболочках содержится немного нуклеиновых кислот.
Однако роль полифосфатов как высокоспециализированных макроэргов, организующих специфику энергоснабжения и питания грибов, не сводится только к участию в структуре клеточной оболочки и требует специального рассмотрения.
Прежде всего необходимо заметить, что полифосфаты грибов — имеют прямое отношение к гранулам так называемого волютина, образующимся в их вакуолях при действии слабых оснований (например, сильно разбавленного аммиака) или основных красителей.
Волютин грибов имеет непостоянный состав в их онтогенезе, способен растворяться не только в кислотах, но и в слабо подщелоченных солях (например, в 0,1 М ЫН4ЫОз, подщелоченном до pH 8,0 и в 2—2,5 М растворе аммиака) (Беккер, 1956). Его накопление согласуется с нарастанием солерастворимой фракции полифосфатов в процессе активного синтеза нуклеиновых кислот (Кулаев, 1975).
Использование цитохимических методов, таких как сравнительная фотосъемка в световом и ультрафиолетовом микроскопе, обработка сформированных волютиновых гранул рибонуклеазой, окраска их пиронином и толуидиновой синей после извлечения из них нейтрального красного этанолом (рис. 1.3) позволили уточнить их состав. В процессе онтогенеза продуцента пенициллина он менялся от состава чисто полифосфатной природы через промежуточные двуслойные структуры к чисто рибонуклеиновому (Дмитриева, Беккер, 1962). Согласно исследованиям Л. Н. Кац (1964), состав предсуществующего волютина изученного ею акти — номицета менялся в диаметрально противоположном направлении—-от РНК-волютина к полифосфатному. По всем этим данным можно с достаточными основаниями утверждать, что волютин грибов несхож с истинным предсуществующим волютином прокариотов, а скорее схож с криномом животных.
Что полифосфатный обмен грибов отличается от такового у ак — тиномицетов и бактерий, можно видеть также и по синтезирующим и расщепляющим полифосфаты ферментам (Кулаев, 1975). Как видно из прилагаемой схемы (табл. 1.6), у грибов, бактерий и актиномицетов есть общие энзимы этого обмена, такие как по — лифосфат-фосфогидролаза (ПФГ), полифосфаткиназа (ПФК) и дифосфоглицерат-полифосфаттрансфераза (ДФГ-ПФТ).
Однако уже такой энзим, как ПФК, переносящий фосфат с АТФ на полифосфат и обратно с полифосфата на АДФ, действует в обоих направлениях только у ЕиЬас1ег1а, а у актиномицетов и
Рис, 1.3. Волютин, сформировавшийся в виде гранул после витальной окраски мицелия Pйnicillium chrijsogenum, из погруженной культуры в его различных возрастных фазах. Обесцвеченные этанолом гранулы в III и в начале IV воз растных фазах окрашиваются в красноватый цвет толуидинблау и не окраши ваются пиронином, т. е. содержат полифосфагы. Начиная с перехода мицелия н V возрастную фазу они окрашиваются пиронином и в синий цвет толуидинбла> і. е. содержат РНК (Дмитриева, Беккер. 1962)
грибов ТОЛЬКО В ОДНОМ И ВЗаИхМОПрОТИВОПОЛОЖНОМ. У грибов сннте. ч полифосфатов за счет АТФ вообще не возможен.
У форм, причисляемых Н. А. Красильниковым (1970) к акти номицетам, имеются кроме этих еще три энзима: полифосфатглю-
|
Таблица 1.6 Включение в метаболизм полифосфатов различных ферментов у бактерий, актиномицетов и грибов (Кулаев, 1975) (стрелками показано наличие ферментов в дайной группе организмов)
|
кокиназа (ПФГК) и полифосфатфруктокиназа (ПФФК), а также полифосфат-АМФ-фосфотрансфераза (ПФ-АМФ-ФТ), отсутствующие у ЕиЬас1ег1а и у грибов. Напротив, грибы обладают, как и в случае многих других их ферментных систем, системой энзимов с действием эндотипа, расщепляющей полифосфаты на разной длины олигомеры в середине их цепи. Эти энзимы действуют в противоположность предшествующим только в кислой зоне pH (оптимальный pH 3,2—3,4) и носят название полифосфатполи — фосфогидролаз, или полифосфатдеполимераз (ПФД), Они, видимо, имеют адаптивный характер.
Полифосфаты представляют собой чисто неорганические соединения, состоящие из мономеров ортофосфорной кислоты, чаще всего построенные в форме линейных неразветвленных цепей, содержащих от трех, четырех и до 300 мономеров фосфата (Кулаев, О II
1975) : —О—Р—О—.Иногда они, видимо, встречаются в форме I!
О
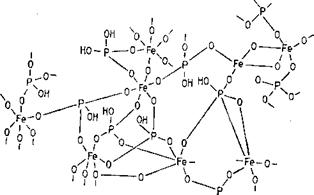
двухфрагментного пирофосфата или циклических метафосфатоз (например, три-, тетра — и гексамерных). Возможны также нестойкие сетчатые структуры и более стойкие сочетания фосфорной кислоты с двух — к трехвалентными металлами, образующими сетчатые структуры с фрагментами ортофосфата, как, например, обнаруженные у грибов (Кулаев, 1975), имеющие функции детоксикато — ров избытка свободного ортофосфата и запасников фосфора и металлов (рис. 1.4).
Наиболее распространенная у грибов и энергетически доступная форма высокомолекулярных полифосфатов представляет собой линейные цепи с очень различным числом фрагментов фосфата, существующие в виде непрерывного ряда соединений от пирофосфата (два фрагмента фосфата) до содержащих 300 фрагментов и более высокополимерных форм. Разделение их на фракции с помощью экстракции разными растворителями является довольно
|
НО’ ‘он Рис. 1.4. Предположительная структура полимерного ортофосфата железа (Кулаев, 1975) |
условным, однако дает все же возможность связать эти фракции с определенной их локализацией и функциями в клетке. Обычно насчитывают четыре-пять таких фракций (табл. 1.7).
Таблица 1.7
|
Характеристика степени полимериости разных фракций полифосфатов ливиых дрожжей (Кулаев, 1975)
|
Согласно способу их экстракции эти фракции носят названия кислоторастворимой (ПФ^, солерастворимой (ПФг), щелочерастворимых (ПФ3 и ПФ4) и растворимой в хлорной кислоте при нагревании (ПФ5). Средняя длина цепи и средняя молекулярная масса каждой фракции, как можно видеть из результатов анализа фракций из дрожжей (см. табл. 1.7), последовательно возрастают, достигая длины цепи порядка 260 п и молекулярной массы около 30 000. При этом четыре из перечисленных фракций были обнаружены у всех подробно изученных в этом отношении грибов (табл. 1.8).
|
Таблица 1.8 Содержание полифосфатав в клетках Епйотусев magnu. sH. Ыеиговрога сга$$а и в плодовых телах ОуготИга е8си1еШа в мг фосфора на г сухого мицелия (Кулаев, 1975)
|
В общем итоге полифосфаты были найдены в мицелии грибов всех обследованных классов, а именно у двух миксомицетов, двух видов мукоровых грибов, восьми сумчатых, двух базидиальных, 13 видов несовершенных и 14 видов дрожжей, т. е. у всех из обследованного 41 вида грибов (Кулаев, 1975). По-видимому, наиболее обильно у грибов представлена фракция ПФг, а в наименьшей степени фракции ПФз и ПФ5, однако их относительное количество сильно зависит от вида гриба, условий его роста и возраста культуры.
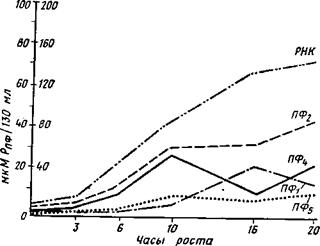
Биосинтез конденсированных полифосфатов по всем данным начинается в основном с наиболее высокополимерной фракции, а остальные получаются путем ее деградации. Однако возможны и восходящие синтезы за счет пирофосфата, освобождающегося в метаболических процессах, например при синтезе нуклеиновых кислот. Этим процессом, видимо, объясняется синхронное с синтезом РНК у йеиговрога сга««а накопление фракции ПФг, сочетающееся с уменьшением содержания наиболее лабильной кислоторастворимой фракции ПФ1 (рис. 1.5).
Общие функции конденсированных линейных полифосфатов в клетках грибов весьма схожи с функциями АТФ и состоят в снабжении для метаболических реакций фосфором и энергией, высвобождающейся при разрыве макроэргической связи —О—Р—. Однако у них есть и сильные отличия от АТФ, так как, во-первых, способность их к высокой степени полимеризации дает возможность резервировать большие запасы энергии и фосфора без нарушения гомеостаза клетки (pH, ионной силы, осмотической концентрации и т. д.). Это очень важно для характерных обилием этих соединений низших эукариот (грибов, водорослей и простейших) и прокариот (бактерий, цианей и актиномицетов), так сильно зависимых от. окружающей их среды. Во-вторых, высокомолекулярные полифосфаты обладают определенной специализацией в метаболических процессах. По всей вероятности, наименее специа-
|
мкМ Ррнк/130 мл
Рис. 1.5. Изменение содержания в мицелии различных фракций полифосфатов и РНК в процессе роста культуры Neuro- spora crassa в микромолях POi~3 иа 130 мл среды (Кулаев, 1975) |
лизирована лабильная фракция ПФЬ участвующая как донор энергии во многих ферментативных процессах и синтезах. Фракция ПФ2 специфично связана с синтезом нуклеиновых кислот. Более высокомолекулярные фракции участвуют в транспорте через клеточную мембрану сахаров, переносчика которых они фосфори — лируют, а их синтез связан с синтезом полисахаридов клеточных оболочек. Последнее можно видеть по высоким коэффициентам корреляции между накоплением этих полисахаридов и соответствующих им фракций полифосфатов (табл. 1.9).
Проведенные Кулаевым, его учениками и рядом других исследователей работы по изучению локализации различных фракций полифосфатов в клетках грибов позволили обнаружить согласо
ванность между процессами, сопровождающими их биосинтез, и местами их накопления в клеточных органеллах. В протопластах Ыеигозрога сгаэБа, освобожденных ферментом улитки от клеточной оболочки, оказались гидролизованными до оставшегося в прото-
|
Таблица 1.9 Коэффициенты корреляции (г) между скоростями накопления различных фракций полифосфатов и полисахаридов у Saccharomyces carlsberglensls (Кулаев, 1975)
|
пласте ортофосфата обе наиболее высокомолекулярные фракции полифосфатов (ПФ4 и ПФ5), что указывало на их локализацию на поверхности клеточной мембраны вблизи от оболочки клетки (табл. 1.10).
Таблица 1.10
|
Содержание высокомолекулярных полифосфатов в клетках, протопластах, ядрах и митохондриях Ьіеиговрога сгаййа. Данные в мг фосфора/г сухого вещества (Кулаев, 1975)
|
Дальнейшее фракционирование нативных клеточных органелл с помощью ультрацентрифугирования в градиенте сахарозы и их анализ показали наличие в ядре только одной фракции (ПФ2), связанной с биосинтезом РНК. Кислоторастворимая фракция
и большая часть солерастворимой фракции (ПФ2), скорее всего входящие в состав волютина грибов, остались в протопласте, где, как известно, протекает гриколиз; в месте локализации дыхательной цепи, в митохондриях, полифосфатов не оказалось совсем Относительно фосфорных соединений необходимо добавить, что, ХОТЯ МЫ И не имеем сейчас ТОЧНЫХ критериев ДЛЯ суждения О СО’ ставе нуклеиновых кислот, можно все же утверждать, что они отличаются у грибов от других организмов по их количественной характеристике. Так, по нашим данным (Беккер, Дмитриева и др.,. 1972), доля ДНК от общего количества фосфорных соединений в мицелии Aspergillus fumigatus ие превышает 7—9%, тогда как. доля РНК достигает 65—70% от их количества. Если сравнить обогащенность клетки ДНК у разных организмов, то выясняется,, что по этому критерию, так же как и по числу пар нуклеотидов на клетку, грибы находятся на относительно невысоком уровне сложности организации их генома, приближаясь в этом отношении к низшим беспозвоночным, как моллюски или губки. Они далеко отстают от высших растений, сложность организации генома которых сопоставима с таковой у птиц, рыб и ракообразных (Ле — нинджер, 1974). Однако при сравнении с бактериями сложность генома грибов оказывается выше на целый порядок (грибы —
0, 02—0,17; бактерии — 0,002—0,06 мкг ДНК на клетку).