По сравнению с фотосинтезирующими организмами в мицелии грибов азота намного больше и азотный обмен у них сильно развит, хотя по объему затрачиваемого на него материала уступает углеродному. Азота в мицелии грибов содержится в 5—б раз меньше углерода. Однако в питательных средах приходится поддерживать соотношение C/N порядка 40/1 (например, в среде Чапека),, что объясняется использованием соединений углерода в качестве источника энергии. Вследствие этого углерод в сравнительно небольшой степени удерживается мицелием, тогда как азот, за не* многими исключениями, когда его соединения служат источниками энергии (окисление аммиака или переработка дезаминированных, аминокислот), остается в нем целиком.
Азот у грибов входит в состав оболочки (в хитин и хитозан),, в белки, пептиды и аминокислоты, в витамины, в большую часть кофакторов и в белковую часть ферментов, в пурины и пиримиди — ны, т. е. в основания нуклеиновых кислот.
По характеру их питания азотом Роббинс делит грибы на четыре группы, использующие:
1) органический азот, NH3, N03- и N2 (т. е. газообразный азот атмосферы);
2) органический азот, NH3 и N03~;
3) органический азот и NH3;
4) только органические соединения азота.
Усвоение атмосферного азота грибами. По имеющимся в научной литературе данным, усваивать атмосферный азот способна: сравнительно узкая таксономическая группа грибов, образующих эндотрофную микоризу, относящаяся к родам Phoma (у вересковых растений) и Rhizoctonia или Orcheomyces (у орхидных — Neottia nidus avis и других).
Первые данные по фиксации азота у Phoma betae были получены в 1901 г. Саида. Далее более детально этот вопрос был изучен в 1907 г. Тернетцем, который установил эту способность имеющимися в то время в его распоряжении методами для пяти: разновидностей Phoma radicis, представляющих собой симбионтов брусники, клюквы, вереска, подбела и Tetralicus. К подобным, содержащим эндотрофную микоризу из рода Phoma, растениям можно, видимо, сейчас отнести также рододендрон, багульник и пустынный кустарник казуарину.
Усвоение азота у трех разновидностей Phoma по данным Тер — нетца, оказалось не уступающим Azotobacter, и составляло от 10,92:
до 22,14 мг азота на 1 г использованной глюкозы, при параллельно испытанной энергии усвоения атмосферного азота у Azotobacter порядка 10,66 мг азота на 1 г глюкозы. Позднее доказывалось усвоение азота атмосферы у Phoma casuarinae, причем в этих целях был использован меченый азот при выращивании этого организма на синтетической среде с сахарозой в атмосфере газовой смеси, содержащей кислород и изотоп азота 15N2. Более поздние опыты с этой культурой не подтвердили предшествовавших данных, поскольку, по-видимому, они проводились с долго поддерживавшимся в искусственной культуре штаммом, который мог утратить способность усваивать азот.
У Orcheomyces (или Rhizoctonia), симбионта орхидных, усвоение азота оказалось близким по объему к Azotobacter (9,8—13,3 мг на 1 г усвоенной глюкозы), но для этого организма доказательства усвоения им азота менее убедительны. В последнее время есть сведения об усвоении атмосферного азота грибами из родов Rho — dotorula и Pullularia (Nicholas, 1965). Анализ этой способности у образователей эктотрофных микориз из числа базидиомицетов привел к отрицательным результатам.
Вопрос об усвоении грибами атмосферного азота еще недостаточно изучен и окончательно не решен. Однако с точки зрения их экологии вряд ли можно сомневаться, что эта способность им присуща, в частности всем эндотрофным микоризам вересковых и многих других растений, характерных для примитивных северных, высокогорных и пустынных почв и бедных азотом торфяных ■формаций болот. Иначе нельзя было бы объяснить возможность существования в этих условиях порой очень мощной растительности (например, лиственничной тайги) в обстановке полного отсутствия бобовых растений и не выносящего кислого pH подзолистой и заболоченной почвы азотобактера. Все подлески таких растительных формаций состоят обычно из содержащих микоризу из рода Phoma вересковых: рододендрона, голубики, черннки, брусники или багульника и клюквы. Взаимоотношения видов Phoma с их растениями-хозяевами, видимо, сходны со взаимоотношениями бобовых растений и клубеньковых бактерий из рода Rhizobium.
Усвоение нитратного азота грибами. Большая часть грибов способна утилизировать ион NO3- как единственный источник азота. До 90% грибов усваивают ионы NO3- и N02~, так как содержат систему ферментов, называемую нитратредуктазой. К их числу, например, принадлежит Aspergillus niger (Терентьева, 1966) или Fusarium oxysporum (Said, Harhash, 1966). He усваивают нитраты только некоторые Saprolegniaceae (исключением из числа которых является использующая их Apodachlya brachynema), а также Blastocladiales и некоторые высшие базидиомицеты. У иих система нитратредуктаз, видимо, отсутствует.
Поскольку эта система является чаще адаптивной и развивается после определенной лаг-фазы, правильнее испытывать способность грибов к усвоению нитратов уже на заранее выращенном мицелии, отмывая его от первоначальной питательной среды перед переносом в среду с нитратами (Nicholas, 1965). Тогда количество* усваиваемого ЫОз_-иона может сильно увеличиться. На первом этапе усвоения иона N03~ происходит его восстановление в ион ЫОг-, который в аэробных условиях может накапливаться в среде в концентрациях до 10~3—10-2 моль/л и проявлять токсический эффект, мешающий дальнейшему усвоению нитрата (Walker, Nicholas, 1961). Например, рост Neurospora crassa ингибируется при достижении концентрацией NaN02 уровня 1-10“3 моль/л и выше, что сопровождается накоплением нитрита в мицелии. Подобное же наблюдалось и у дрожжей.
Существуют виды грибов, усваивающие ион N03_ лучше, чем ион NH^"1", например Alternaria poonensis. Не усваивает N03—hoh Pйnicillium ammoniophylum, описанный Шапошниковым и Ман — тейфель, и плохо усваивает ряд мукоровых грибов, среди которых находятся Phycomyces blakesleeanus, Rhizopus nigricans, Zygor — hynchus moelleri, виды Absidia и Mucor. Из числа базидиомицетов — слабо усваивают нитраты виды Marasmius, Lenzites trabea, Pleuro — tus ostreaius и ряд других.
Усвоение грибами нитритов. Грибы более толерантны к иону азотистой кислоты, чем бактерии, что связано с их способностью’ переносить низкие значения pH. Большая часть видов грибов, усваивающих нитраты, усваивает и нитриты, если этому не препятствует токсичность HNO2, как в случае дрожжей и растущей в кислой среде Cereospora (Thind, Mandahar, 1965). Ион N02- менее токсичен, чем сама азотистая кислота (HNO2), поэтому в; нейтральных средах усвоение этого источника азота усиливается. Хорошо используют нитрит Fusarium niueum, Phymatotrichum om — nivorum, Scopulariopsis brevicaulis, Coprinus sp., Rhizophlyctis rosea.
У Scopulariopsis brevicaulis скорость усвоения нитрита соизмерима со скоростью усвоения нитрата и иона аммония, а именно составляет 1,2 мг азота на 1 г массы сухого мицелия в час. При добавке иона NH4+ в культуру 5. brevicaulis, выросшего йа среде с нитритом, усвоение последнего практически не подавляется и он используется параллельно иону аммония, т. е. этот гриб не утрачивает своей адаптации к нитриту. Наоборот, при добавке иона NO2“ в культуру, выросшую на среде с аммонийным источником азота, азотистая кислота почти не используется, а ассимиляция иона NH4+ подавляется в течение двух суток, после чего оба иона используются с одинаковой скоростью. Эти эксперименты подтверждают адаптивность системы нитрат — и нитритредуктазы.
Усвоение иона аммония. Обычно слабо усваивают нитраты и хорошо ион аммония зигомицеты, ряд базидиомицетов и дрожжи. Барьер клеточной мембраны аммоний обычно преодолевает в форме недиссоциированного аммиака. Скорость проникновения соответствует градиенту его концентраций по обе стороны клеточной мембраны и скорости его потребления на биосинтез. Ход потребления аммония у грибов, например у Pйnicillium griseofulvum и Fusarium graminearum, сходен и протекает быстрее при более высоком pH среды. Однако одновременно усвоение аммиака происходит тем быстрее, чем ниже внутриклеточное pH. Например, у F. graminearum и Aspergillus niger с их более низким pH внутри клетки оно происходит интенсивнее, чем у 5. brevicaulis (Nicholas, 1965).
Усйоение азота сильно зависит от источника и объема углеродного питания. Так, при наличии слабо используемых источников углерода и NHi+-HOHa, в качестве источника азота возможна интоксикация мицелия аммиаком. Такой случай наблюдается у Му — rothecium verrucaria, рост которого в подобном сочетании угнетался даже в присутствии иона №)з_. Однако при добавке глюкозы он хорошо рос на винно-кислом аммонии илн в сочетании сернокислого аммония с органическими кислотами. Сходные явления были обнаружены у 5. brevicaulis (Morton, McMillan, 1954/ табл. 4.1).
Т аб л ица 4.1
|
Рост мицелия и ассимиляция азота у Scopulariopsis brevicaulis, (Morton, McMillan, 1954)
|
Подобный эффект органических кислот состоит в связывании поступающего в клетку аммиака, регуляции pH клетки и облегчении включения аммиака в аминокислоты.
Использование грибами смешанных источников азота. Общим явлением у грибов оказывается подавление ассимиляции иона нитрата при одновременном введении в среду иона аммония, тогда как введение иона N03_ не подавляет ассимиляции аммиака (Morton, McMillan, 1954).
В этом отношении сходно ведут себя такие виды, как Scopulariopsis brevicaulis, Alternaria solani, Aspergillus repens, Botrytis allii, Cladosporium herbarum, Diplodia natalensis, Mucor ramma — nianus, Trichoderma viride, Myrothecium verrucaria и Pйnicillium, chrysogenum. Некоторые виды, к числу которых относятся Aspergillus niger, A. oryzae, Fusarium graminearum и Pйnicillium griseo — fulvum, способны использовать иоиы нитрата и аммония одновременно (Nicholas, 1965).
При неравномерном использовании ионов из вносимых в среду солей, как в вышеприведенных случаях с Myrothecium verrucaria, Scopulariopsis brevicaulis, а также с культурой Piricularia oryzae, вследствие более быстрого использования источника азота в форме
NH4+-HOHa из сернокислого аммония, среда сильно подкисляется за счет остающегося в ней в избытке иона S04[4]. В результате этого может тормозиться рост гриба. Однако в случае Piricularict oryzae, рост может быть восстановлен при добавке в среду солей органических кислот как источник углерода, аммонийных солей (например, (NH4)2HP04) или нейтрализующего среду мела. Стабилизацией pH среды объясняют также благоприятное действие на усвоение иона NH4+ у Aspergillus сукцината. При его потреблении происходит нейтрализация среды (Agnihotri, 1966).
Использование смешанных источников азота, например аммонийной селитры (NH4N03), значительно зависит от pH среды. Лв — pergillus niger при pH более 3,0 усваивает в первую очередь ион аммония, в более кислой среде преимущественно переходит к иону нитрата. Порог pH, равный 3,0, близко подходит к уровню изо — электрической точки (ИЭТ) белка мицелия A. niger, т. е. к точке равновесной диссоциации анионов и катионов белка цитоплазмы. При pH ниже ИЭТ белок диссоциирует с избытком катионов, при pH выше ИЭТ — с избытком анионов. Поэтому в первом случае происходит преимущественная адсорбция белком цитоплазмы анионов, а во втором — катионов. Бюннинг и Роббинс продемонстрировали эти явления у грибов на модели адсорбции ими базо — фильных и ацидофильных красителей, имеющих соответственно окрашивающую часть молекулы в форме аниона или катиона, объяснив таким образом механизм преимущественного использования ионов в зависимости от pH среды и уровня ИЭТ и белков цитоплазмы.
Эффект органических кислот в отношении облегчения усвоения аммиака сводится не только к его нейтрализации при поступлении в клетку. Вторая роль их состоит в облегчении включения его в аминокислоты путем трансформации их в соответствующие ке — токислоты. Поэтому в основном усвоению иона NH4+ способствуют органические кислоты с четырьмя атомами углерода, как янтарная, фумаровая и винная, трансформирующиеся в аспарагиновую кислоту, а также с двумя и тремя атомами углерода, как молочная, пировиноградная и уксусная, дающие начало аланину и глицину. Применяют их в среде в концентрациях порядка 0,1—0,2%. Примером этого может служить благоприятное действие на усвоение иона аммония фумаровой кислоты у базидиомицетов и винной — у Chaetomium globosum.
. Нитратредиктаза. .
1зтап Ы03 + НАДФН*Н +————————————— N02 + НАДФ++Н20
|
НАДФН +НЧ |
|
N02 — +3 |
|
2 этап — Состояние окисл.-восстан. атома Н |
|
Нитроксил N$02 Нитроксид (гипонитрит) |
|
N0 ———— 5»- (N0Н) ————- Нитритредуктаза |
|
|
|
|
|
|
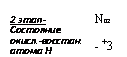 |
|
|
|
Путь переноса электронов
|
1-2. |
|
■Си |
|
|
||
|
|||
НАДН
3этап: (N0Н)———- ЫН20Н
Состояние Гипонитрит пиЛ^%ит£иПт~ Гидроксиламин
окисл.-босстан. +) * -/
атома N
|
и этап; Состояние гидроксил- окисл.-босстан ■ амин а тома N -1 |
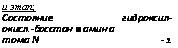 Гидроксиламин- , редуктаза
Гидроксиламин- , редуктаза
Г^НгОН + НАДН + Н —- ИН,+НАД + Н, а
Фл + 8В
-3
Рис. 4.1. Схема процесса усвоения нитратов грибами
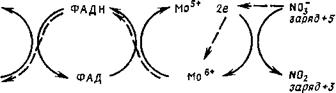
Второй этап, осуществляемый ферментом нитритредуктазой, состоит в переходе с потерей молекулой еще двух электронов из нитрита в нитроксид (N0) и затем в иитроксил (ЫОН) или гипо — иитрит. На этой стадии возможен также переход без потери валентности из нитроксила (КОН) в Ы202 и далее в Ь120 и обратно. Наличие этого промежуточного этапа подтверждается существованием у Nеигозрога эизима, восстанавливающего нитрит до ок
сида азота (1) (Walker, Nicholas, 1961), причем у грибов показана способность усваивать это соединение (Nicholas, 1965). В процессах второго этапа восстановления неорганического азота участвуют как кофакторы НАДФ, ФАД, цитохром и ион меди.
Третий этап восстановления, протекающий с участием энзима гипонитритредуктазы, состоит в восстановлении гипонитрита до гидроксиламина. Гипонитритредуктаза была обнаружена у Neuro — spora, причем выяснилось, что кофактором ее является восстановленный НАД.
Четвертый этап состоит в восстановлении гидроксиламина до аммиака, протекающем с участием НАДН при действии фермента гидроксиламинредуктазы. Реакция восстановления гидроксиламина в аммиак была установлена у Neurospora. Энзим оказался так же, как и в двух первых этапах восстановления азота флавопротеином, нуждающимся в пиродоксине и в металлах, которые подавляются хелирующими агентами. Для синтеза гидроксиламинредуктазы оказались необходимыми марганец и магний, нужные также и для синтеза нитрит — и гипонитритредуктаз (табл. 4.2).
|
Таблица 4.2 Действие дефицита металлов на активность нитрит-, гипонитрит — и гидроксиламинредуктаз Neurospora crassa (Medina, Nicholas, 1957)
|
Для функции нитрит — и гипонитритредуктаз оказались необходимыми железо и медь, а молибден только для нитратредуктазы (Medina, Nicholas, 1957). Из других металлов для синтеза нитратредуктазы необходим также цинк.
Весь процесс восстановления нитрата в целом нуждается в следующих кофакторах: НАДФ (или НАД), ФАД, сульфгидрильных группах (табл. 4.3), в фосфате (сходный эффект дают также арсе — нит и пирофосфат), а на этапе синтеза гидроксиламинредуктазы еще в пиридоксальфосфате. В последнем этапе возможно образование комплекса (промежуточного) с гидроксиламином, в начале в форме оксима, а потом амина.
Пятый этап — утилизация аммиака для биосинтеза аминокислот— протекает при участии глютаминдегидрогеназы и состоит в аминировании а-кетоглютаровой кислоты с параллельным восста-
|
Обща я схема потребности в компонентах редуктазиой системы при восстановлении нитрата и других соединений азота у грибов (Nicholas, 1965)
|
новлением ее кетогруппы (R—СО—) в группу R—CHNH2. Такой энзим был найден у Neurospora crassa (Nicholas, 1965), причем было выяснено, что для его биосинтеза требуется цинк. У грибов глютаминдегидрогеназа — ключевой энзим для продукции органических соединений азота, и мутанты, не имеющие этого энзима (например, мутант Neurospora N2003), не растут на средах с ионом аммония в качестве источника азота, а только на содержащих аминокислоты. Общая схема потребностей энзимов системы нитратредуктазы в различных кофакторах приведена в табл. 4.3.
Возросший в последнее время интерес к механизму азотфикса — ции прокариотными организмами привел к широкому ряду работ по общему изучению молибденсодержащих ферментов, в том числе и нитратредуктазы — первого комплекса энзимов в пути восстановления неорганического азота до аммиака, оказавшегося у прокариотов тесно связанным с фиксирующим азот воздуха ферментом нитрогеназой. При этом были затронуты и грибные организмы, в частности дрожжи Rhodotorula glutinis и дефектный по молибденовому компоненту мутант nit-1 Neurospora crassa (Ketchum et al., 1970; Ketchum, Sevilla, 1973; Pan, Nason, 1978).
Ассимиляторная нитратредуктаза эукариотов, осуществляющая двухэлектронное восстановление нитратов в нитриты, оказалась двухкомпонентным комплексом из диафоразы, содержащей как кофакторы у грибов НАДФН (Львов и др., 1980), и терминальной молибденсодержащей нитратредуктазы (табл. 4.4). Промежуточ-
|
Таблида 4.4 Характеристика ассимиляторных нитратредуктаз грибов (Львов и др., 1980)
|
ным переносчиком между ними служит цитохром Ь557, а вся схема переноса восстановленных эквивалентов на нитрат выглядит следующим образом:
НАДФН -+• ФАД ->• цитохром Ьш -* Mo -> N0,.
Днафораза Терминальная
нитратредуктаза
У прокариотов эта цепь ограничена двумя последними компонентами с донором электронов в форме ферродоксина или его химического аналога метилвиологена. Кофакторы молибденсодержащих ферментов оказались общими для целого ряда энзимов, таких как нитратредуктаза, ксантиноксидаза, альдегидоксидаза, сульфитоксидаза и ксантиндегидрогеназа (Маккена и др., 1974; Львов и др., 1980). У Neurospora crassa этот кофактор оказался низкомолекулярным (Ketchum, Sevilla, 1973), что подтвердилось при самосборке ее нитратредуктазы (Pan, Nason, 1978), тогда как кофактор, входящий в состав нитрогеназы прокариотов, содержит не менее восьми атомов железа и шести атомов серы на один атом молибдена (Shah, Brill, 1977). Однако молибденовый компонент их нитратредуктазы в 2—4 раза ниже по молекулярной массе, чем у эукариот, и содержит не два, а только один атом молибдена (см. табл. 4.4). Исследования по нитратредуктазам и нитрогеназе еще не закончены и продолжают пополняться новыми сведениями.
Кроме нитратов грибы способны восстанавливать также и органические нитросоединения, например ж-нитрозонитробензол в л-нитроанилин. Такая реакция описана у Neurospora (Nicholas, 1965), а восстановление n-нитробензола у Aspergillus niger.
У грибов установлено так называемое азотное дыхание, т. е. окисление соединений азота, возможной целью которого является получение энергии, аналогичное подобному процессу у бактерий нитрификаторов (Nicholas, 1965). Материалом для этого окисления служит аммиак, выделяющийся в результате дезаминирования аминокислот, и обнаруживают эту способность чаще всего у почвенных гифомицетов, обитающих в условиях южных пустынных почв, бедных источниками углерода (Aspergillus flavus, A. wentii, Penicillium atrowenetum). Процесс окисления, видимо, идет у них в направлении, обратном процессу восстановления нитратов, так как среди промежуточных продуктов его обнаруживаются гидрок — силамин и нитрит, а заканчивается процесс образованием нитрата. Впрочем, энергетическое значение этого процесса в настоящее время подвергается сомнению (Мирчинк, 1976).
