Как боковые ветви обмена углерода, заканчивающиеся биосинтезом и накоплением специфических веществ экологического или структурного назначения, могут функционировать и основные пути обмена, при условии блокирования дальнейшей трансформации промежуточных продуктов биосинтеза, накапливающихся в клетке или в культуре. Примером этого может служить накопление этилового алкоголя у дрожжей (спиртовое брожение) или молочной кислоты у мукоровых грибов или, наконец, маннита у видов рода Aspergillus. В основе этих боковых путей углеродного обмена лежит всего один дополнительный этап, состоящий в восстановлении образующихся метаболитов и отвлекающий эти продукты из путей основного обмена.
Однако существуют специальные многоэтапные боковые пути биосинтеза, отобранные в процессе эволюции как важные экологические приспособления. Особенно много таких приспособительных биосинтезов существует в путях обмена жиров и терпенов. Как тот, так и другой пути исходят в основном из ацетата или, вернее, из ацетил-КоА.
Обмен жиров и образование полиэнов. Жирные кислоты и жиры имеют наиболее близкое отношение к основному обмену, так как являются структурными элементами клетки, обеспечивающими сохранение раздела сред почти во всех мембранных клеточных структурах (клеточные мембраны, митохондрии, аппарат Гольджи и т. д.). Видимо, липиды, а в особенности стероиды и фосфолипиды, являются не только запасными веществами, хотя и эту роль они тоже играют, а составляют компоненты структурных элементов клетки, обеспечивая определенные механизмы проницаемости, последовательность биохимических реакций и поддержку определенной структурной организации клеточных элементов. Особое значение они имеют для функционирования многочисленных мембранно-связанных энзимов.
Липиды занимают очень важное место в обмене грибов, это можно видеть уже из данных по их общему количеству (Weete, 1980), которое, с одной стороны, может достигать больших величин от сухой массы, а с другой — может сильно колебаться в зависимости от внешних условий и возраста культуры.
Особенно большие количества липидов находили у ряда муко — ровых грибов (до 40—55%), у дерматофитов (45—56%), у некоторых рас дрожжей (до 65—87%) и у Chaetomium globosum (54%). То, что при отдельных анализах их количество сильно меняется, например, у Claviceps purpurea в 15 раз, а у Tilletia nudus более чем в 200 раз и почти у всех мукоровых грибов в 10 раз, указывает на очень активное участие липидов в их обмене веществ, сопровождающееся либо их синтезом, либо распадом.
В составе липидов грибов и других организмов обычно различают шесть фракций: углеводороды, стеролы, их эфиры, жирные кислоты, их глицериды и фосфолипиды, среди которых наиболее мощные фракции у грибов составляют триглицериды жирных кислот и фосфолипиды (Weete, 1980).
У отдельных таксономических и экологических групп соотношение фракций может меняться (табл. 3.2). Например, почти у всех дрожжей более важное место по сравнению с триглицеридами занимают эфиры стеролов, тогда как у исследованного представителя оомицетов Pythium ultimum фосфолипиды уступают место свободным жирным кислотам (см. табл. 3.2).
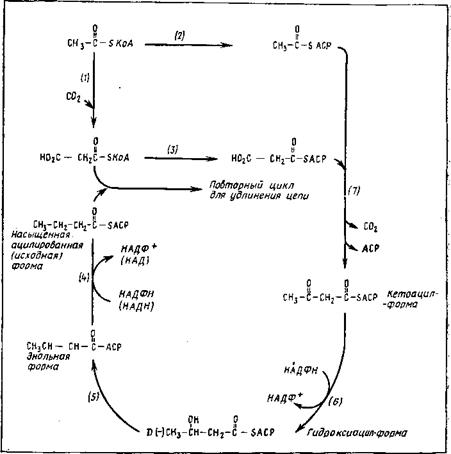
Принципиальная схема биосинтеза насыщенных жирных кислот исходит из малоновой кислоты, точнее из малонил-КоА, образующегося из ацетил-КоА путем включения в него СОг, происходящего
|
Сравнение фракционного состава липидов грибов из разных таксономических групп (-|—|—|—30—60%; -]—[-—10—30%; -|—-10%)
|
аналогично образованию щавелевоуксусной кислоты из пировино — градной. В этой реакции также участвуют биотин и используется энергия фосфорных связей, получаемая от АТФ. Во всех реакциях биосинтеза жирных кислот ведущую роль занимает КоА (рис. 3.8).
Первый этап биосинтеза насыщенных жирных кислот состоит во включении С02 в ацетил-КоА, в результате чего образуется малонил-КоА.
Во втором этапе происходит конденсация малонил-КоА с новой порцией ацетил-КоА, в результате чего синтезируется содержащий пять атомов углерода ацетомалонил-КоА. ,
Вслед за этим протекает третий этап—восстановление и де — карбоксилирование ацетомалонил-КоА с образованием бутирил — КоА, содержащего уже четыре атома углерода. В этой реакции принимает участие НАДФ-Н.
Конденсация с малонилкоэнзимом А может повторяться боль — шее число раз, каждый раз сопровождаясь декарбоксилированием и восстановлением, что приводит к добавлению на каждой ступени по два атома углерода к образующейся цепи жирной кислоты. Принимающие в этом процессе участие энзимы и кофакторы приведены в схеме на рис. 3.8, 3.9.
Образование насыщенных жирных кислот обычно происходит на фоне более восстановленного режима обмена, т. е. при относительно низком pH системы, тогда как насыщенные жирные кислоты требуют для биосинтеза большего преобладания процессов окисления, т. е. более высокого уровня pH и участия в биосинтезе окисленной формы НАД+. При этом ацилированная форма насыщенной жирной кислоты (И—СО—БКоА) отдает по второму и третьему атомам углерода два атома водорода и по этим атомам углерода образуется двойная связь. По ней может присоединяться с помощью энолгидразы молекула воды, образуя оксикислоту, которая при вторичном окислении НАД+-дегидрогеназой дает кето- кислоту, способную отщеплять по кетогруппе фрагмент ацетил-КоА. Образующиеся в результате такого окисления и расщепления жир-
|
СН3 СОСООН Пирубат |
|
Насыщенные мирные кислоты (Фон восстановления с денарбоксилиробанием) |
|
г //с-нечетный),;СООН Г СН2(СН2)п-г СО СНС05 КоД-у 2С. Ацилмалонил КоА 6С |
|
СН3СН2СН2С0СНС05К(М Бутиромалонил КоА ТС ( С’ четный) СНз(СН2]п СООН Мирные кислоты> ы полиэны СН3СН2СН2 сов КоА Бутирил КоА |
|
Н0Н2С-СН0Н-СН20Р/ / 1-глицеросроссрат/ / ‘ /л |
|
СООН зс СН005 КоА — Малонил КоА |
|
СООН I |
|
Г |
|
+2Н |
|
/ / С021£ (-/ сн |
|
Л |
|
СО |
|
СН3С05 код Ацетил коА |
|
^ СН3(СН2)4С05КОЛ — Капронил КоА СО 21 ^ •" |
|
СООН I |
|
|сн3сосн2сокоу I Ацетоацетил/ КоА |
|
СН3 СОСНСОЗ КоА — Ацетомалонил КоА |
|
С2Н> |
|
Жиры |
|
СС — четный) СН3(СН2)„.2СН=СНС05 КОЛ Дегидроацил КоА /-2Н |
|
СН3СН0НСН2С05 КОА,/з-ОН — бутирил "- |
|
[С-четный) СН5(СНг)п-гСОСН2СОМА ЛЗ — кетоацил ко А |
|
КоА |
|
СН2СН = СНС0 5ЯОА Крот о ни л КоА |
 |
 |
![]()
![]()
![]()
СН3(СН2)п.2СНОНСН2С05 КоА /З-СН — ацил КоА (С — четный}
Ненасыщенные Мирные кислоты
(Фон окисления без денарбоксилирования)
Рис. 3.8. Сопряженная схема биосинтеза насыщенных и ненасыщенных жирных
кислот
ные кислоты обычно содержат на два атома углерода меньше в их цепи, чем исходные. Описанный процесс известен под названием р-окисления. Повтор первых двух этапов может привести к образованию полиенов и жирных кислот с высокими уровнями ненасыщенное™. Этот процесс протекает в основном в митохонд-
|
Рис. 3.9. Путь биосинтеза жирных кислот (Veete, 1980). БСоА — коэнзим А; БАСР — переносящий ацильные группы протеин. Участвующие в синтезе жирных кислот энзимы: / — ацетил-КоА-карбоксилаза; 2 — ацетил-КоА-АСР-транс — ацилаза; 3 — малонил-КоА-трансацилаза; 4 — эноил-АСР-редуктаза; 5 — 3- гидрокси-АСР-дегидраза; 6 — 3-кетоацил-АСР-редуктаза; 7 — кетоацил-АСР- синтетаза |
риях с участием карнитина в переносе через мембрану (рис. 3.10) ацилированных жирных кислот.. Это хорошо согласуется с отмеченным ранее (Беккер, 1956, 1963) совпадением снижения количества жиров в мицелии продуцента пенициллина и других грибов с дифференцировкой клеточных структур, в частности с сильным обогащением митохондриями. Напротив, более ранний в их онтогенезе период накопления жиров характерен, судя по цитохимическим признакам, обилием в гифах микросомальной фракции.
Приведенное выше представление о ходе биосинтеза жирных кислот требует некоторых дополнений: во-первых, порядок очеред — иости формирования жирных кислот в настоящее время трактуется как последовательность от кетоформы, через гидроксиформу и энольную, к насыщенной форме, а не наоборот (см. рис. 3.8). Обратный порядок приписывается не синтезу, а использованию жирных кислот. Во-вторых, у грибов обнаружен путь формирования ненасыщенных жирных кислот из насыщенных, который локализован в микросомальной фракции цитоплазмы и включает окси — геназную систему с участием цитохрома 450, весьма сходную с таковой у дрожжей (Veete, 1980). Порядок реакций в этой системе следующий:
НАДН -> НАДН-цитохром Ъъ редуктаза цитохром Ьъ ЦЧФ -*
-> пальмитил КоА + 02 пальмитолеил КоА + Н20 (ЦЧФ—цианидчувствительный фактор)
Данные о сравнительных свойствах синтетаз жирных кислот у разных организмов (Veete, 1980) показали, что у грибов они ближе к синтетазам млекопитающих. Синтетазы как у животных, так и у грибов представляют собой не индивидуальные энзимы (как у бактерий и растений), а мультиферментные системы.
Распад жиров в клетках грибов происходит в более поздних стадиях онтогенеза либо при формировании из ненасыщенных жирных кислот низкомолекулярных насыщенных фрагментов (Беккер, 1956, 1963), либо при полном их окислении с последовательным отщеплением двухуглеродных фрагментов ацетата, деградирующих в цикле трикарбоновых кислот до С02 и воды. Распад этого типа (р-окисление) энергетически очень продуктивен, так как окисление каждого двухуглеродного — фрагмента дает формирование пяти молекул АТФ, для начальной же активации этого процесса требуется только одна молекула АТФ.
Уравнение реакции трансформации жирной кислоты: Жирная кислота С18 + 1 АТФ+8 КоАБН + 7 ФАД+7 НАД+—>-8 АцКоА+ —7 ФАДН2+7 НАДН+7 Н++АМФ+РР„ (пирофосфат). Исходя из этого рассчитано, что при распаде одной молекулы пальмитиновой кислоты (жирная кислота С^) с последующим полным окислением восьми молекул ацетил-КоА в цикле ТКК получается выход 130 молекул АТФ на одну молекулу жирной кислоты, которые составляются из 21 моля АТФ в результате окисления восьми молей НАДН (3X7 НАДН), 14 молей АТФ при окислении ФАДН2 (2X7 ФАДН2), а также из 95 молекул АТФ от окисления восьми молекул АцКоА (12X8 АцКоА) — 1 АТФ на активацию. Выход энергии в калориях на 1 моль кислоты С18 равен 2330 ккал/моль, что дает КПД порядка 42% (Veete, 1980).
Сходным образом с жирными кислотами синтезируются, а подчас используются в обмене полиэны с большим количеством двойных связей, которые часто являются антибиотиками почвенных грибов или входят в их состав; например, кротоновая и декатетра — эновая кислоты, входящие в состав антибиотиков трихотецина и фумагиллина, а также антибиотики палитантин и фреквентин.
Обычно особенно богаты жйрами приспособления грибов, предназначенные для сохранения вида в экстремальных условиях температуры или при недостатке воды, как склероции или хламидоспоры. Это объясняется, с одной стороны, защитной ролью жиров в повышении стойкости к изменениям температуры и к потере влаги, а с другой — их функцией как энергетического и строительного резерва для биосинтезов при прорастании.
В связи с их важной функцией в составе клеточных мембранных структур липиды, в особенности их фосфолипидная фракция, в частности и у грибов, стали изучаться особенно детально. Исследован жирно-кислотный состав мицелия и плодовых тел около 200 видов грибов, данные о которых приведены в сокращенном виде в табл. 3.3.
Из результатов исследований, в табл. 3.3, можно извлечь в основном только довольно тривиальный вывод о преобладании у грибов вообще пальмитиновой и олеиновой кислот, а начиная с муко-
|
Таблица 3.& Распространение жирных кислот в составе липидов грибов из различных таксономических групп (>^ее1е, 1980) (-]—]—1-) — 20—30% от суммы жирных кислот; (++) — Ю—20%; (-|-)—1—10%; (±)—данные расходятся у разных видов; (—) — отсутствует
|
ровых грибов и выше в порядке их эволюции дополнительно линолевой и в меньшей мере линоленовой. Из кислот более высокомолекулярных приуроченностью к определенным группам грибов обладает кислота С2ом (арахидоновая), присущая, видимо, ооми — цетам и с большей степенью достоверности энтомофторовым гри-
Ациллипиды
|
Цитозоль |
Жирные кислоты ІЇ0А5Н ~,АТФ(2)
|
ЯСН2(СН2)П СН-СН2 СОКоА (В) Рнс. 3.10. Транспорт ацильных еднннц через митохондриальную мембрану н 0- окисление жирных кислот (по Veete, 1980). Промежуточные продукты: (А) — транс-Д2-ацил-КоА; (В) — Ь(+)-В-гидроксиацнл-КоА; (С) — Р-кетоацил-КоА; (О) — ацетнл-КоА; (Е) — ацнл-КоА. Участвующие в транспорте энзимы: 1 — липаза; 2 — ацнлтнокнназа; 3 — ацнл-КоА-карнитинтрансацилаза; 4 — ацил — дегндрогеназа; 5 — эноилгндратаза; 6 — 3-гидроксиацилдегндрогеназа; 7 — 3- кето ацнлтиолаза |
|
^Наружная ідриал ш |
|
АМФ + РР |
|
АцилКоА (3} |
|
Митохондриальная мембрана |
|
(СН3)з ж:Н2СНСН2СООН ОН Карнитин |
|
КоА5Н Ацилнарнитин |
|
Внутренняя |
|
♦ |
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|



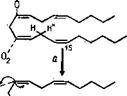
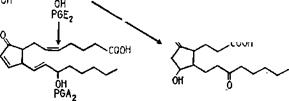
шественником простагландинов, осуществляющих регуляцию хода воспалительных и аллергических процессов и стимулирующих активность фермента, синтезирующего циклический АМФ, аденилат-
|
соон |
![]()
|
соон |
![]()
|
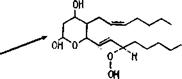
5,8,11, Ш-Эйкозатетраэновая (арахидоноВая) кислота |
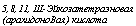
0 н ЇЇ
Н н ^
0-^4^=^ХС00Н
Пероксик’ислота (изображена В Виде переки. снога радикала)
|
соон |
![]()
|
Тромбоксин А, |
 0
0
1
|
соон |
![]()
|
ли 1 |

|
он Р6Е, |
![]()
|
^Катаболизм 0. |
|
СООН |
![]()
|
Рис. 3.11. Биосинтез простагландинов н некоторые реакции их распада: а — реакция сходная с действием липооксигеназы, в ходе которой происходит отщепление протона (Н+) у С—13; б — формирование простагландине йг; в, г, д — формирование соответственно простагландинов На, Е2 н Его; д — восстановительное расщепление перекиси. Стрелки прн РСЕг„: 1 — в простагландинах ряда 1 эта двойная связь отсутствует; 2 — в простагландинах ряда 3 присутствует еще одна двойная связь (Мецлер, 1980) |

 ОН РЭЭ2
ОН РЭЭ2
циклазу, которые имеют очень различную направленность действия в зависимости от типа, является 5,8,11,14-эйкозотетраэновая, или арахидоновая кислота (рис. 3.11). В связи с проблемой ее биосинтеза у ряда грибов состав липидов изучался в последние годы
более подробно. В научной литературе опубликовано много материалов на эту тему. В частности, изучались грибы из класса зиго — мицетов (мукоровые и энтомофторовые) и некоторые несовершенные грибы со своеобразной экологией нематофагов или микопаразитов.
У хорошо освоенного в промышленных условиях продуцента каротиноидов В/а&ея/еа (Скоаперкога) Ыэрога липиды представлены в основном триглицеридами и несколько в меньшей степени суммарной фракцией фосфолипидов и моноглицеридов, дополняемых позднее формирующимися стеролами и свободными жирными кислотами (Дедюхина, Бехтерева, 1968). Состав их характеризуется обилием пальмитиновой, стеариновой, олеиновой, линолевой и линоленовой кислот, с некоторым преобладанием насыщенных кислот над ненасыщенными. В культуре на глюкозе количество последних со временем увеличивается, чего не происходит в культуре с добавкой я-гексана (Бехтерева и др., 1969). Среди жирных кислот, находящихся в составе фосфолипидов В. (шрота, есть различия между культурами разного пола (+ и — штаммами). Например, олеиновой кислоты больше у штамма ( + ), тогда как линолевой у штамма ( —), хотя степень насыщения суммы жирных кислот у обоих штаммов примерно равна, а в смеси их в 3 раза выше. Качественный их состав близок к общим липидам, но несколько уже и не включает представителей с наиболее короткой (С)2) и наиболее длинной (Сго) цепью.
Образование липидов у В. и’юрота оказывается до некоторой степени коррелирующим с синтезом каротиноидов (табл. 3.4), что,.
Т аблица 3.4
|
Биомасса, липиды и каротииоиды в мицелии В1аке$1еа 1зрога при росте на среде с различной концентрацией глюкозы (Дедюхина, Бехтерева, 1969)
|
возможно, связано с их общим происхождением из ацетил-КоА (рис. 3.10 и 3.12), хотя возрастание последних в зависимости от содержания сахара в среде намного превосходит возрастание концентрации общих липидов и триглицеридов (Дедюхина, Бехтерева, 1969).
Исследование жирно-кислотного состава фосфолипидов двух видов мукоровых грибов из того же, что и Шакеэка семейства
СЬоаперЬогасеае, а именно СиппШцкатеИа е^апз и С. Ьото1а1- Иса, показало сходные с фосфолипидами В/а&еЛеа Шарога результаты. В обоих случаях ведущими в составе фосфолипидов оказа-
|
|
|
|
|
С15 СН3 1 3 * р |
|
(Вб) >С=СНСН, СН, С=СНСН, СН, С=СНСН, ОРР гн * ‘-пз Фарнезилфосфат |
|
i (86) |
|
СН, |
|
СЗО 1C Н5 |
|
>С=СНСН2СН2С=СНСН2СН2С=СНСН2ОРР I сн3 Скоаленфосфат СНД СН, ^Ch ХСН2 I с н= с7 |
|
СН |
|
(95) |
|
Ланостерол^н. |
|
СН, |
|
сзо |
|
н3с сн3 |
|
Другие стеролы (антибиотики, токсины, Витамины) |
|
_>С=СНСН2СН2С=СН-СН20РР С10-—- Монотерпены Циклизация Циклические монотерпены ПО | Циклизация Циклические сескВитерпены С15 (спирты и кислоты: фумигаллол, тр’ихотекол,,гиббереллан и т. п.) Конденсация (7а) *———————- Геранилгераниол С 20 Вторичная конденсация (8а) Каротиноиды С 40 ПоВторные конденсации Латекс (С)п |
|
1+Нг0 сн;соон I |
|
Повторные CH3C0(CH2C0)nSKoA конденсации Ацетоацетил -/7-КоА |
|
(3) |
|
С6 |
|
(ч) |
|
Ароматические С5 |
|
сн, соон |
|
МеВалонат |
|
Циклизация СН3С(0Н)СН2СН20Н |
|
|+0РР ТрифосфомеВалонат |
|
С=СН-СН20РР |
|
CH3C(0H)CHjC0SKoA га/И^КоА 1 — КоА СН2С00Н сн, с(он)сн, сон |
|
Ч-Метилоксиглу — С 6 |
|
МеВалдат |
|
(2) |
|
+2Н |
|
С6 |
 |
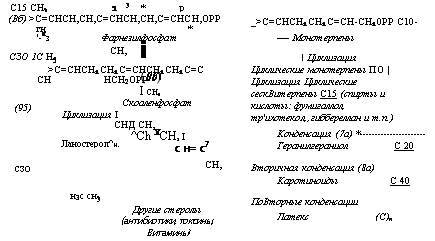 |

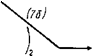
Рис. 3.12. Схема обмена терпенов (Miller, 1961), модифицированная н дополненная применительно к грибам
лись пальмитиновая, олеиновая и линолевая кислоты, в стабильно близкой концентрации включались пальмитолеиновая и стеариновая. Коэффициент насыщения, показывающий преобладание при-
мерно в три раза ненасыщенных форм, был почти идентичен у всех трех видов. Единственными отличиями видов рода Сипп^катеИа оказались стабильное присутствие у них от 7 до 12% линоленовой кислоты и расширение качественного состава жирных кислот, в особенности в сторону высокомолекулярных, вплоть до содержащих 24 атома углерода в цепи (Бехтерева, Яковлева, 1980).
Своей специфичностью сильно отличается от жирно-кислотного состава мукоровых грибов аналогичный состав общих липидов видов рода ЕМоторМкога, растущих на синтетической среде с бак — топептоном и дрожжевым экстрактом, что исключает заимствова — яие состава от насекомых, на которых они обитают в природе (Попова и др., 1980).
Он оказался очень разнообразным, включая для вида ЕМото — рМкога thaxieri 26 жирных кислот с размером цепи от 9-углерод — ной до 24-углеродной, против 13, установленных у В/а&ев/еа Ы — ярога. Он характерен обилием низкомолекулярных кислот типа лауриновой и миристиновой, в ущерб пальмитиновой и стеариновой, и обилием высокомолекулярных (С18—С2о) ненасыщенных жирных кислот с различно расположенными двойными связями, что, в общем, снижает степень насыщенности их суммы.
Кроме всего этого особенно обращает на себя внимание наличие у них разветвленных (изоформ) жирных кислот и обилие доходящей до 10% состава у Е. №ах1ег1 высоконенасыщенной (Сго^) — арахидоновой кислоты, что характерно для липидов некоторых животных, в частности для червей — гельминтов (Зоргипоу, 1978).
В процессе развития культур ЕШоторМкога количество (в зависимости от вида) различных жирных кислот имеет таксономическое значение, хотя наиболее высокомолекулярные (Сьв, Сгом) сохраняются в течение вегетации на мало изменяющемся уровне (Попова и др., 1980). Жирно-кислотный состав фосфолипидов двух видов ЕЫоторЫИога сходен с составом их в общих липидах этого рода и в нем также обильны миристиновая и пальмитиновая кислоты, хотя качественный состав компонентов уже (23 жирных кислоты вместо 29 в общих липидах). Присутствуют также разветвленные изоформы жирных кислот, а количество арахидоновой кислоты (С20:4), возможно важной для снижения ригидности клеточных мембран хозяев этих паразитных грибов, доходит к концу роста до 13—18% общего состава. Судя по уровню коэффициента насыщения ненасыщенность фосфолипидов у этого рода еще более выражена, чем в случае жирно-кислотных компонентов общих липидов. Состав жирных кислот фосфолипидов у исследованных видов сходен, за исключением большого преобладания у Е. сошса пальмитолеиновой кислоты (20—23% Сил)..
Из числа дейтеромицетов исследовался состав общих липидов четырех видов (в числе пяти штаммов) хищных грибов из рода АгШгоЬо^уз, специализированных на залавливании нематод (Рад — жабова и др., 1980). Фракционный состав этих липидов довольно закономерно отличается в зависимости от используемой для их выращивания среды, причем, хотя на среде Мейзе с глюкозой количество их оказывается большим, чем на среде Стефанини с сахарозой, количество фосфолипидов при росте на последней возрастает в 2—3 раза. У всех видов Arthrobotrys на обоих средах в составе липидов обильно представлены триглицериды (от 25 до 80%) и стеролы (до 12%)- Последние являются компонентами биогенеза терпенов, продукты которого, видимо, участвуют в форме латексов; и токсинов в актах хищничества грибов этого рода (Беккер, 1972). Жирно-кислотный состав общих липидов, в котором преобладают пальмитиновая, олеиновая и линолевая кислоты, относительно узок,, что, как и в случае Blakeslea trispora, можно объяснить конкуренцией этого пула с шунтом терпенов (Arthrobotrys, как и Blakeslea^ синтезирует каротиноиды и, кроме того, много других веществ, формирующихся по этому пути).
Также относительно узок жирно-кислотный состав общих липидов у продуцента сесквитерпенового антибиотика трихотецина,. формирующегося также в шунте терпенов, микопаразита Tricho — thecium roseum. Однако его отличает обилие накапливающихся одновременно с антибиотиком на третий-четвертый дни культивирования высокомолекулярных сильноненасыщенных жирных кислот, в частности арахидоновой, количество которой не уступает обнаруживаемому у Entomophthora (Зеленева и др., 1979).
При сравнении жирно-кислотного состава фосфолипидов акти — номицетов и грибов (Ковальчук и др., 1980) обнаруживается сходство по содержанию пальмитиновой, пальмитолеиновой и олеиновой кислот. Отличие состоит в меньшем диапазоне вариаций в числе атомов углерода в цепи у актиномицетов, в большей насыщенности жирных кислот и обилии их с нечетным числом атомов; углерода в цепи.
По проценту жирных кислот с нечетным числом атомов углерода в цепи особенно сильно отличаются от актиномицетов сапрофитные мукоровые грибы родов Blakeslea и Cunninghamella, в фосфолипидах которых они полностью отсутствуют, что указывает на преобладание у них обычного пути синтеза и деградации жирных кислот с участием ацил-КоА. Напротив, наличие жирных кислот с нечетным числом атомов углерода указывает на изменения путей их биосинтеза со включением малоната без дальнейшего декарбок — силирования (см. рис. 3.8). Сближение в этом отношении с акти — номицетами возможно для паразита насекомых Entomophthora и хищного гриба Arthrobotrys, но насыщенность жирных кислот, обеспечивающая им более свободное функционирование мембранно-связанных ферментов, у грибов выше. Необходимо отметить, что наиболее высокомолекулярные и сильноненасыщенные жирные — кислоты (например, арахидоновая) встречались исключительно у мико — или энтомопаразитов (Trichothecium и Entomophthora), а также у некоторых паразитов растений из числа оомицетов, как Pythium и Phytophthora (см. Weete, 1980).
Как уже упоминалось выше, особенно важную структурную роль липиды, в том числе и жирные кислоты, играют в строении клеточных мембран, как ограничивающих клетку в целом, так и ее вакуоли и митохондрии. Данных в этом направлении, касающихся грибов, пока немного и они ограничиваются примерами из числа дрожжей. Жирно-кислотный состав плазмалеммы и митохондриальных мембран близок и, как и в общих липидах, характерен преобладанием пальмитиновой, олеиновой, а также пальмит — олеиновой кислот.
Однако главным определяющим свойства различных мембран компонентом являются не столько жирные кислоты, сколько их •сочетания с другими компонентами фосфолипидов, в частности с холином в фосфатидилхолине (PC), с этаноламином в фосфати — дилэтаноламине (РЕ), с инозитом в фосфатидилинозите (PI), с се — рином в фосфатидилсерине (PS) и с дифосфатдиглицерином в кар- диолипине (CL). Все эти формы фосфолипидов встречаются у грибов, и сочетания их в структуре плазмалеммы и тонопласта отличаются много сильнее, чем жирно-кислотный состав (табл. 3.5).
|
Таблица 3.5 Состав плазмалеммы и тонопласта Saccharomyces cerevtstae (по Weete, 1980)
|
|
* Фосфолипиды выражены как процент липидного фосфата. |
Прежде всего липидов в тонопласте примерно в 2 раза больше, чем протеина, тогда как в плазмалемме отношение обратное. Основной фон в липидах мембран составляют не фосфолипиды, а сте — ролы, превышающие по молярности фосфолипиды, особенно в плазмалемме в 3—9 раз. Главным из них, особенно в плазматической мембране, является эргостерин. По составу отдельных фосфолипидов в клеточной мембране и тонопласте тоже имеются различия, вероятно, имеющие отношение к различиям в их функциях. Например, в плазмалемме отсутствует лизофосфатидилхолин, тогда как только в ней обнаруживается фосфатидная кислота.
При общем анализе фосфолипидных компонентов у грибов из различных таксономических групп выявляется общее правило обилия во всех их группах РС и РЕ. В группах сумчатых и высших базидиальных грибов учащаются встречи реже наблюдаемых у низших грибов PS и PI, тогда как у дрожжей почти в равной мере с ними представлен и CL. Отмечается также не только качественное, но и количественное сходство в наборе фосфолипидов,, например у всех близких к роду Saccharemyces дрожжей, у представителей родов Fusarium и Cephalosporium.
Состав фосфолипидов разного типа в плазмалемме, митохондриях, микросомах и тонопласте дрожжей и в респираторных частицах спорыньи, приведенный в табл. 3.6, показывает наиболее-
|
Таблица 3.6 Состав глицерофосфолипидов субклеточных фракций Saccharomyces cerevislae, S. carlsbergiensis и Claviceps purpurea (Weete, 1980)
Примечание. PA — фосфатидная кислота, PG — фосфатидилглицерин*. PC—фосфатидилхолин, РЕ—фосфатидилэтаноламин, PL—фосфатидилинозит, CL—кардиолипин, PS—фосфатидилсерин. |
широкое разнообразие этих компонентов в митохондриях и наиболее узкое в составе РС, РЕ и Р1 в тонопласте. Постоянно преобла— дают во всех фракциях мембран РС, РЕ и Р1. Структурная роль стеролов, в особенности эргостерина, пути биосинтеза которого излагаются ниже, несомненно очень велика для мембранных образований, так же, как и роль мембранных белков, которая, к сожалению, еще недостаточно изучена.
Синтез терпенов и ароматических соединений
Шунт терпенов у грибов особенно часто несет функции обмена <с экологическим назначением, так как в нем синтезируется особенно большое количество соединений типа антибиотиков, токсинов, пигментов и других веществ с конкурентной, агрессивной (у паразитов) и защитной функцией. Этот путь биосинтеза начинается с ацетилкоэнзима А как и биосинтез жиров (см. рис. 3.12/МП — 1ег, 1961), в частности с образования, при конденсации двух молекул ацетил-КоА, ацетоацетилкоэнзима А, т. е. четырехуглеродного продукта из двух, содержащих по два атома углерода. Во втором этапе этого пути биосинтеза происходит повторная конденсация ацетоацетил-КоА с ацетил-КоА с образованием шестиуглеродного соединения, метилоксиглутарил-КоА. Утрачивая в дальнейшем связь с коэнзимом А, это соединение трансформируется в мевалдовую кислоту, содержащую кроме карбоксила еще и альдегидную группу.
В четвертом этапе биосинтеза терпенов это соединение восстанавливается с образованием мевалониевой кислоты, у которой альдегидная группа мевалдата заменена спиртовой. Одновременное наличие у мевалоната спиртовой гидроксильной и карбоксиль — лой групп наделяет это соединение способностью к дальнейшим процессам циклизации и конденсации. В результате этого оно ■часто является исходным пунктом для дальнейших биосинтезов. многих циклических соединений типа антибиотиков, пигментов и других, которые образуются при конденсации его с содержащими различное число атомов углерода фрагментами ацил-А.
Однако основной путь биосинтеза обычно приводит к фосфо — рилированию мевалоната, который в следующем, пятом, этапе этого метаболизма декарбоксилируется, трансформируясь в изо — пентенилфосфат или диметилаллилфосфат, содержащие по пять атомов углерода каждый и имеющие структуру, характерную для изопренов. В дальнейшем биосинтез может идти по двум альтернативным путям, но постоянно при участии фосфорилирования. Один из путей состоит в конденсации этих двух соединений в десятиуглеродную цепь алифатического или циклического строения. •Соединения этого типа после их дефосфорилирования оказываются летучими и обладают сильно выраженным ароматическим запахом, входя в состав эфирных масел высших растений. Такие ароматические соединения, видимо, встречаются также и у многих грибов, например у хищных грибов из рода АгШгоЬо1гуз (Беккер, 1972).
Такие соединения с десятиуглеродным строением носят название монотерпенов и могут конденсироваться далее с образованием дитерпенов, содержащих двадцать атомов углерода (или четыре изопреновых фрагмента). Примером дитерпенов может служить геранилгераниол, который считается основным предшественником каротиноидных пигментов, широко представленных у грибов (Гудвин, 1954). Образование геранилгераниола и каротиноидов, види
мо, также происходит за счет использования энергии фосфорных связей, дающнх возможность конденсации до сорока атомов углерода каротиноидов, концевые группы которых могут далее цикли — зоваться с образованием а — и ^-иононовых групп. Описан способ их формирования СУее1е, 1980).
У целого ряда грибов, например у рода Ьас1аг1из из базидио — мнцетов и у хищных грнбов нематофагов (Беккер, 1972), могут образовываться также латексоподобные вязкие и клейкне вещества, концентрирующиеся либо в клетках плодовых тел (у /,ас^а — гш$), лнбо на поверхности ловчих колец мицелня (у хищного гриба А. НкгоЪоиу8 н подобных ему видов).
По-видимому, такие вещества представляют собой изотерпено — вые высокомолекулярные соединения, сходные по составу н биогенезу с латексом высших растений и образующиеся из моно — и димеров терпенов по этому же пути метаболизма. Как и латексы каучуконосов, они застывают на воздухе, превращаясь в вязкие и упругие резиноподобные вещества при их окислении. Их экологическое назначение еще не всегда понятно, однако в случае хищных грибов, залавливающих нематод, они несомненно принимают участие в акте хищничества.
Второй альтернативный путь биогенеза терпеновых соединений состоит в конденсации одной молекулы диметилаллилфосфата с двумя молекулами нзопентенилфосфата с образованием пятнадцатиуглеродного соединения — фарнезилфосфата, дающего начало большому классу циклических терпенов, носящих название сесквн — терпенов. Этот синтез так же, как и последующая конденсация
|
Н+ Сквален Скдален-2! 3-эпоксид |

|
Ланостерол |
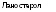
|
Циклоартенол |
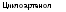
|
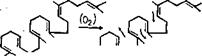
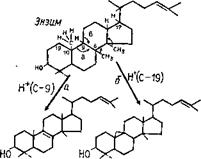
Рис. 3.13. Циклизация 2,3-сквалена с образованием ланостерола (у животных н грнбов) или цнклоартенола (у растеннй/Шее! е, 1980) |
 двух молекул фарнезилфосфата в соединение с тридцатью атомами углерода — фосфо- рилированный сквален, происходит, как и ранее, при использовании энергии фосфорных связей. Дальнейшая циклизация сквалена приводит к образованию ланостерола, нз которого образуются очень обильные н разнообразные у грибов циклические соединения из класса стероидов.
двух молекул фарнезилфосфата в соединение с тридцатью атомами углерода — фосфо- рилированный сквален, происходит, как и ранее, при использовании энергии фосфорных связей. Дальнейшая циклизация сквалена приводит к образованию ланостерола, нз которого образуются очень обильные н разнообразные у грибов циклические соединения из класса стероидов.
Следует отметить, что именно путь биосинтеза стеролов является одним из наиболее ярких биохимических признаков, отличающих грибы от растений и бактерий приближающих их обмен к животным. Это отличие наблюдается уже на первом этапе синтеза стеролов в момент циклизации
сквалена (рис. 3.13), когда из сквалена 2,3-эпоксида в случае грибов и млекопитающих формируется ланостерол, а в организмах растений и у микроорганизмов — циклоартенол.
Принципиальные различия в ходе биосинтеза стеролов, в их групповом составе и происхождении у растений, животных и грибов заключаются в следующем.
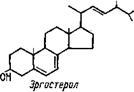
Главным стеролом большинства грибов является принадлежащий к группе 4-десметил-С28-стеролов эргостерол, биосинтез которого идет через ланостерол, зимостерол, фекостерол и эргоста — •3,24-диэнол:
|
|
Эргостерол, являющийся у большинства грибов наиболее обильным и постоянным стеролом, сопровождаясь большей частью некоторыми другими стеролами из той же группы 4-десметил-Сг8- стеролов, отсутствует только у оомицетов из порядка 8аргоІе£ПІа- Іев и у ржавчинных грибов (табл. 3.7). Возможно, что последние заимствуют характерные для них стеролы из группы стигмастерола у растений, на которых они произрастают. Однако такое предположение по поводу сапролегниевых грибов исключается. Здесь можно только, как и в случае их клеточной оболочки, почти целиком состоящей из целлюлозы, отнести факт отсутствия у них эргосте — рола к их иному происхождению, чем у грибов, синтезирующих хитин и эргостерин и тяготеющих к свойствам обмена, характерным для животных. В противоположность к ним оомицеты в части синтеза как полисахаридов, так и стеролов явно тяготеют к метаболизму, характерному для растений.
Обе альтернативно формирующиеся в шунте терпенов группы циклических соединений — циклические спирты, образующиеся из фарнезола, и стеролы, производные сквалена и ланостерола, играют у многих грибов важнейшие экологические роли и обладают очень ярко выраженными различными видами биологической активности. Сесквитерпеновые спирты входят в состав противогриб — ных антибиотиков и токсинов, известных под общим названием трихотецеиов (трихотецина, роридина, триходермина, веррукари — на/Кожибски и др., 1969; Беккер, 1972), а также антифаговых, протистоцидных (фумагиллин) и нематоцидных веществ (Беккер, Раджабова, 1972). Их содержат специфические индукторы роста и развития высших растений гормонального типа, продуцируемые грибами, например гибереллин.
Из числа стеролов помимо обильно продуцируемого грибами провитамина Б — эргостерина, само название которому дали рожки спорыньи, грибы образуют антибиотики типа полипореновой
Распространение преобладающих стеролов в различных таксономических группах грибов (Veete, 1980); обозначения: (+++) — 100%; (4-+) — » 50%; (+) — 30—50% видов
|
Таксономическая группа |
Число испытан — иых видов |
4,4, 14- трнметнл |
4-десметил С27 (группа холестерола) |
4-десметил С28 (группа эргостерола) |
4-десметил С29 (группа стигмастерола) |
||||||
|
лано- СтерОЛ |
холе- стерол |
десметнл- стерол |
фунги- стерол |
дегидро- стерол |
метилен- стерол |
эрго- стерол |
Л7стигма — стэиол |
стигмаста* 7-24-дие- нол |
Фуко- стерол |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
Сапролегииевые |
9 |
+++ |
++ |
+++ |
+++ |
||||||
|
Хитридиевые |
1 |
+ |
+ |
+ |
|||||||
|
Мукоровые |
12 |
||||||||||
|
Дрожжи |
4 |
++ |
+++ |
||||||||
|
Пиреиомицеты |
3 |
++ |
++ |
||||||||
|
Дискомицеты |
1 |
+ |
|||||||||
|
Плектасковые |
9 |
++ |
+ |
+++ |
|||||||
|
Дейтеромицеты |
|||||||||||
|
темноокрашениые |
о |
+ |
+++ |
||||||||
|
Головневые |
3 |
+ |
+++ |
+ |
+++ |
+ |
|||||
|
Ржавчинные |
6 |
++ |
+++ |
++ |
|||||||
|
Афиллофоро вые |
6 |
+ |
+ |
++ |
|||||||
|
Агариковые |
1 |
+ |
+ |
||||||||
|
+ |
кислоты у базидиомицетов, гельволевой кислоты у Aspergillus fu — migatus, фуцидина у Acremonium fusidioides, розололактона у Tri — chothecium roseum и токсины, подобные токсинам Fusarium из секции Sporotrichiella (Олифсон, 1957).
Весь обмен терпеновых соединений обычно протекает на фоне низкого гН и поддерживается в условиях восстановления, в результате чего в процессе его лишь изредка образуются кислоты, а главным образом спирты и даже углеводороды, например летучие терпены, каротиноиды и латексьг. Эта особенность приводит еще к одной важной экологической роли этих соединений. Они, например каротиноиды, нередко несут в обмене грибов функции антиоксидантов, предохраняющих их от избыточного окисления.
Подобную же роль противолучевых экранов и антиоксидантов играют, видимо, и синтезирующиеся по пути, сходному с синтезом стероидов или ароматических аминокислот, меланины (Allport, Bu’Lock, 1960; Жданова, 1976), распространенные у темноокра — шенных сумчатых грибов и гифомицетов, у которых их ритм спорообразования регулируется светочувствительными факторами, например рибофлавином. Такой случай наблюдается у гифомицета Alternaria (Luckens, 1963).
Очень многие биологически активные вещества грибов относятся к ароматическим соединениям, производным бензола, нафтола и т. п. Относительно путей их образования существовал ряд гипотез, которые в последнее время свелись в основном к двум: 1) образование через шикимовую кислоту, изученное на бактериях и биохимических мутантах Neurospora crassa, и 2) через конденсацию производных и аналогов мевалониевой кислоты между собой или с ней самой, структура которой весьма пригодна для циклизации. Последний тип синтеза многократно изучался методом меченых атомов на очень многих видах грибов.
Биосинтез производных бензола (или фенола) через шикимовую кислоту идет следующим образом (рис. 3.14/Miller, 1961). Происходит циклизация продуктов пентозного шунта обмена, вероятно исходя из стадии седогептулозы, которая приводит к образованию 5-дегидрошикимовой кислоты. 5-дегидрошикимовая кислота способна как прямо трансформироваться, при ее восстановлении и отщеплении молекулы воды, в 3,4-дигидроксибензойную кислоту, так и восстанавливаться до шикимовой кислоты. В свою очередь шикимовая кислота может превращаться, при ее восстановлении и аминировании, в антраниловую. В этом же пути метаболизма образуется фенилпировиноградная кислота.
Второй путь биосинтеза производных фенольного ряда возможен через конденсацию соединений терпенового типа, сходных с мевалониевой кислотой, или с мономерами изопренового строения (Vanek, Sucek, 1962).
Образование ароматических соединений у грибов имеет значение не только в связи с биосинтезом антибиотиков и ряда пигментов, но также связано с их ролью в отношении формирования гумуса почвы, весьма сходного по своему составу с меланиновыми
пигментами грибов. Это сходство проявляется как в элементарном составе гумуса и меланинов (Мирчинк, 1976), в среднем количестве азота между меланинами растений и животных, так и в других параметрах (экстинкция при А = 465 нм, молекулярная масса). Меланины грибов, судя по обилию в них азота, видимо, в значительной мере составлены из остатков ароматических аминокислот
Глюкоза——————— ———- Неидентифицированное соединение „V"
(или седогептулоза)
5-дегидро — ,~0Н_____________________ f’-i
STf" 0 v^~:5roV’o»’^»oV’o»
5-Вегидрохинная Хинная
кислота кислот
СООН
+ЗН________
-3H,0+NH3
Н0^°Н Антрониловая
ОН ип „ гиглота
3 Ц-дигидрокси — Шикимовая ’ бензойная кислота
кислота
Рис. 3.14. Биосинтез ароматических соединений через шикн — мовую кислоту, изученный с помощью мутантов Neurospora crassa (Miller, 1961)
подобно индольным меланинам животных, хотя, вероятно, в них «сть примесь и чисто углеродсодержащих типа меланина Г)аШШа сопсе^пса (АПроН;, Ви’Ьоск, 1960) или пирокатехольного меланина высших растений (Жданова, 1976).
ОН
I
X/S он он
Мелаиин (Daldinia concentrica)
Сравнительный элементарный состав меланина показал, что он содержит приблизительно от 1 до 4% азота против 0,7% в мела
нине высших растений и от 5 до 9% — в меланине животных (Мир — чинк, 1976; Лях, Рубан, 1972). Безазотистый меланин грибов, вероятно, синтезируется подобно стеролам в шунте терпенов, тогда как синтез индольного меланина, видимо, относится к азотному обмену и протекает по пути, изученному у животных, исходящему из шикимовой кислоты. Синтез последней описывался выше и подробно изучен на модели мутантов Neurospora crassa.
Путь биосинтеза индольного меланина исходит из тирозина и протекает с участием молекулярного кислорода и обильного у грибов фермента тирозиназы, трансформирующей тирозин сначала в диоксифенилаланин (ДОФА), затем в дофахинон и, наконец, после образования пятичленного азотсодержащего кольца, в 5,6-ди — оксииндол-2-карбоновую кислоту. Последняя при действии окси — дазы трансформируется в красный пигмент ДОФА-хром со свойствами хинона, теряет карбоксильную группу, превращаясь в 5,6-диоксииндол, и окисляется затем в соответствующий хинои, способный в дальнейшем при окислении полимеризоваться, образуя меланин.
Пути образования меланина у паразита хлопчатника Verticil — lium dahliae (Bell et al., 1976; Sete, Yonohara, 1977; Stipanovic, Bell, 1977), y паразита риса Piricularia oryzae (Sisler, Tokousbali — des, 1979) обобщены Сислером. Этот путь биосинтеза меланина исходит из ряда гидроксилированных и окисленных нафталинов, как сциталон и вермелон, из которых далее формируется 1,8-ди — гидроксинафталин, конденсирующийся в меланин. Угнетение три — циклазолом образования меланина у P. oryzae не сопровождается подавлением синтеза сходного с его предшественниками токсина P. oryzae — пирикуляриола, а, наоборот, усиливает его продукцию, что указывает на конкуренцию его биосинтеза с биосинтезом меланина.
Грибы способны образовывать и другие конденсированные соединения, например, имеющие характерное пятичленное лактонное кольцо тетроновой кислоты (Bu’Lock, 1961). Эти соединения образуются путем конденсации какой-либо оксикислоты, чаще молочной или яблочной, с другой кислотой, например уксусной:
RjCH (ОН) СООН + R2COOH
| — н2о, он-
RjCH СО———— R2
О со
Особенно часто этот тип соединений встречается у видов рода Pйnicillium (P. charlesii, P. viridicatum, P. terrestre, P. cinerascens), хотя они есть и у других грибов (табл. 3.8).
В числе образуемых грибами органических кислот встречаются и такие, которые синтезируются путем дополнительных трансформаций кислот цикла Кребса. К таким относится образуемая Asper-
|
Тетроновые кислоты плесневых г рибов (Bu’Lock, 1961)
|
gillus terreus и A. itaconicus итаконовая кислота, видимо, получающаяся в результате метилирования по второму углероду и окисления янтарной кислоты:
4 СООН
I
0 C=CHB
1 COOH
Она имеет большое практическое значение как сырье для изготовления синтетических полимеров. Очень часто встречаются у грибов также гетероциклические соединения с включением в углеродный скелет какого-либо другого атома, чаще всего азота или серы, или с перемежающейся конденсацией аминокислот с жирными кислотами, например, при синтезе антибиотиков рода Fusarium, носящих название депсипептидов.