Цитоплазма грибов, как. и у других организмов, структурирована в форме ретикулума и имеет характер системы мембран с периодическими цистернами и уплотнениями. Такая мембранного типа цитоплазма была обнаружена у Rhizopus nigricans и у ряда дискомицетов, у которых были найдены образования типа вакуолей, сходные с аппаратом Гольджи животных, но в форме отдельных цистерн с секреторными вакуольками 0,3 мкм в диаметре (Necas et al., 1964), . •
В форме микровакуолей выявляются содержащие пратеолитиче — ские ферменты и участвующие в лизисе клеточных органелл лизо —
сомы, особенно обильные в периоды, предшествующие лизису вегетативных структур у грибов.
В цитоплазме могут быть локализованы в виде пучков или обособленных телец микротрубочки, участвующие в построении ядер — ного веретена (Girbardt, 1962), микротельца с еще неясными функциями и составом, мультивезикулярные образования и отдельные пузырьки, являющиеся местами локализации ферментов и материалов для построения клеточных структур.
Из других, помимо упомянутых липидов, запасных веществ, используемых в энергетическом обмене, в цитоплазме клеток грибов часто встречается гликоген, в a-форме в виде звездчатых образований или в разветвленной р-форме (Камалетдинова, Васильев,
1982) . С переработкой гликогена, видимо, связано присутствие в молодых, интенсивно
растущих сумках дискомице — тов цистерн с ламеллярной мембранной структурой
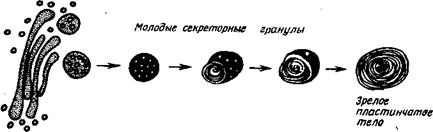
(рис. 7.8), встречающихся и у 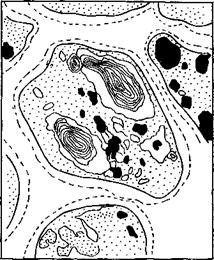 других грибов, например в мицелии Pйnicillium chrysogenum
других грибов, например в мицелии Pйnicillium chrysogenum
fKiirvlnwir7 Pt я 1 14804 Чти Рис — 7-8- Схема формирования концент-
* У О г al., lyoUj. а И рических секреторных вакуолей в моло-
структуры, так же как и пят — дой сумке дискомицета Rhytisma salici-
нистые электронно-плотные пит (по Камалетдиновой, 1975)
гранулы, вероятно, являются
центром образования обильной
слизи, характерной для сумок плодовых тел дискомицетов. Процесс их формирования имеет поразительное морфологическое сходство с формированием слизи сурфактанта в легочных альвеолах животных (рис. 7.9) (Ерохин, Филиппенко, 1981).
Структуры типа цистерн гладкого эндоплазматического рети — кулума могут быть местом синтеза или временными вместилищами экзоферментов, фитотоксинов и антибиотиков, выделяемых грибами в окружающую среду. Такого рода сведения известны для высокопродуктивного штамма Pйnicillium chrysogenum, у которого местом накопления пенициллина являются подобные цистерны d = 40 нм, расположенные по периферии клетки близ плазмалеммы (см. атлас Kurylowicz et al., 1980/рис. 101). Наличие в них пенициллина показано с помощью обработки мицелия меченной фер — ритином 0-лактомазой. Фракционирование клеточных структур методом ультрацентрифугирования и определения в них радиоактивной метки Предшественника и содержания пенициллина подтвердило эти заключения, показав максимальную активность того и другого в больших вакуолях и в цистернах с диаметром 40 нм (табл. 7.2).
|
Рис. 7.9. Схема формирования секреторных гранул в цитоплазме клеток легочных альвеол млекопитающих, в которых синтезируется слизистый сурфактант (Ерохин, Филиппенко, 1981) |
Микросомальные фракции цитоплазмы с частицами, близкими по размерам к рибосомам и эндоплазматическим цистернам грибов и дрожжей из родов Candida, Torulopsis, являются центрами
|
• Таблица 7.2 Органеллы, изолированные из клеток Pйnicillium ckrysogenum, и содержание в них антибиотика (по Kurylowicz et al., 1980)
|
системы энзимов — оксигеназ, производящих окисление углеводов и эндогенных липидов, где характерным для этих систем компонентом является цитохром Р-450 (Veete, 1980). Подобные ферменты эндоплазматического ретикулума являются основным компонентом, формирующим бесклеточную люминесцирующую систему гомогената из клеток нитчатых грибов, функционирующую на основе системы люциферии-люцифераза (А1гШ е! а1., 1969).
Поровые аппараты грибов не могут быть отнесены к самостоятельным органеллам клетки, так как являются частью поперечной клеточной септы. Самостоятельное значение поровых устройств как лабильных клеточных органелл заключается в том, что они либо разрешают обмен клеток питательным материалом или даже органеллами вплоть до ядер, либо полностью замыкают их от соседствующих с ними сегментов мицелия. Поскольку у грибов дру-
|
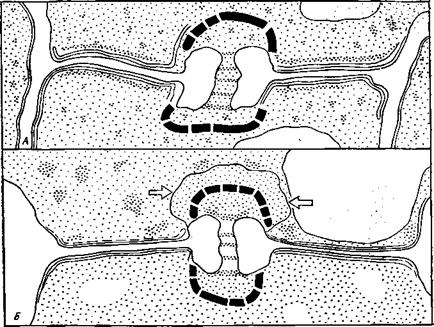
Рис. 7.10. Схема долипор плодового тела базидиомнцета Agrocybe praecox: а — септа гимениальной области; б — септа в пограничной области между гимением и субгимением. Электроино-плотный колпачок присутствует только со стороны субгимеиия (стрелки); такие же колпачки окружают с обеих сторон септы до- липоры, расположенные в ткани остального субгимеиия (Gull, 1978) |
гих средств связи между клетками, таких как плазмодесми, не существует, то она возможна для них только через поры септ, и состояние мицелия с замкнутыми пробками может рассматриваться как одноклеточное, а сам мицелий — как популяция одноклеточных форм, что может привести к далеко идущим выводам в плане экологии и генетики.
Сложные долипоры базидиальных грибов обратили на себя внимание давно, и изучение их показало, что они снабжены боковыми выростами — парентосомами, прикрывающими сверху от-
верстие септы двусторонними колпачками (Gull, 1978) и затыкающими туннель поры пробками, состоящими из белковых филамен — тов, растворяемых протеолитическими энзимами (Flegler et al., 1976). В вегетативном мицелии голобазидиальных агариковых грибов долипоры обычно закрыты пробками и колпачками парен — тосом, тогда как в гимении плодовых тел в обрамлении долипор наблюдаются перфорации, а пробки и колпачки отсутствуют (рис. 7.10, а, б) и обмен цитоплазмой и органеллами между сег-
|
Рис. 7.11. Схема септальной поры медуллярного эксцнпула плодового тела дис — комнцета МогскеИа соЫса, закрытая пластинчатыми тельцами Воронина (ТВ): С — септа; Пл — плазмалемма (по Камалетдиновой, Васильеву, 1982) |
ментами гиф плодового тела протекает беспрепятственно. Закрытая колпачками и пробками зона остается только на границе ги — мения и субгимения, причем колпачок и неперфарированное обрамление сохраняются только на пограничной стороне субгимения (Burnett, 1968). Это правило соблюдается также у сумчатых дис — комицетов, у которых изолирующие устройства пор располагаются обычно между гимением и субгимением с пограничной стороны последнего (Камалетдинова, Васильев, 1982). У дейтеромицетов такие изолирующие устройства наблюдаются в местах отчленения конидий или между отдельными клетками в многоклеточных конидиях, исчезая при их прорастании (Murrey, Maxwell, 1976). Они встречаются и в гифах мицелия продуцента пенициллина Pйnicillium chrysogenum (см. атлас Ktirylowicz et al., 1980, рис. 42).
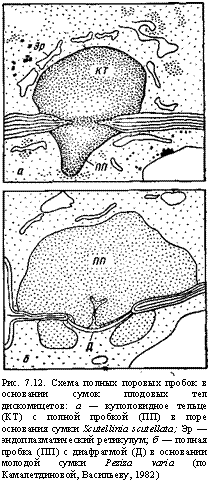
У сумчатых грибов из порядка дискомицетов имеется чрезвычайное разнообразие замыкающих поровых устройств (Камалет- динова, Васильев, 1982/рис. 9). Их известно не менее пяти: диафрагмы, куполовидные тельца, тельца Воронина, полосатые тельца и пробки. Для более примитивной группы иноперкулятных дискомицетов характерно лабильное и наименее плотное замыкание поры тельцем Воронина, которое происходит, возможно, с помощью сократительных движений микрофиламентов.
|
Рис. 7.12. Схема полных поровых пробок в основании сумок плодовых тел дискомицетов: а — куполовидное тельце (КТ) с полной пробкой (ПП) в поре основания сумки Scutellinia scutellata; Эр — эндоплазматический ретикулум; б — полная пробка (ПП) с диафрагмой (Д) в основании молодой сумки Peziza varia (по Камалетдиновой, Васильеву, 1982) |
 Тельца Воронина дисковиХной формы в такой закрытой поре могут быть расположены по нескольку штук (рис. 7.11).
Тельца Воронина дисковиХной формы в такой закрытой поре могут быть расположены по нескольку штук (рис. 7.11).
Такие изоляции весьма лабильны. Они легко открываются н снова закрываются в зависимости от физиологического состояния клеток гиф, регулируя при этом ток цитоплазмы или поступление питательных веществ из одного сегмента гиф в другой. Формирование изолирующих устройств в виде телец Воронина не связано со старением гиф или только с экстремальными условиями среды, как наблюдалось ранее у Neurospora (Trin — ci, Collinge, 1974) и у Ascod. es — mis sphaerospora (Brenner,
Carrol, 1968). Так, в активно растущих жизнеспособных колониях Erysiphe graminis до 80% септальных пор закрыты пробками из телец Воронина (МсКееп, 1971), что говорит о их роли в специализированной дифференциации обмена.
Изолирующее устройство оперкулятных дискомицетов и иноперкулятных форм включает кроме телец Воронина еще и диафрагму — линзообразное герметичное образование в просвете поры, происходящее от пролиферации септы и ограниченное с двух сторон плазматической мембраной. Разрастание и перекрывание диафрагмы фибриллярным или гранулярным материалом формирует еще более герметичное куполовидное тельце. В ряде случаев диафрагма замеща-
|
о ‘ ШШШ |
:.:-4 1 | |
|
{ /-ч 0909Ф0Ф —————————— |
|
|
I 9ФФ9ОДФ ——————————- |
…… 1 |
|
ЕШЯШШШШШ№тШЯШШЯЯШ |
|
|
Гл………………………….. 1 1 I — •" 1ГТТ’|ПТП |
|
|
1^… .. . _________ 1____ 1. … _______________ _1… 1 О 1 |
1111МПИ |
|
1Р 1 |
|
|
К> 11111 |
|
|
‘Ш 288881 1 |
. 1 ^ |
Рис. 7.13. Схематическое изображение результатов цитохимического анализа распределения протеинов, иуклепротеидов, липидов и углево — дов в клеточных органеллах ЫеигоБрога сгаэБа после центрифугирования мицелия (направление центробежной силы слева направо); / — распределение органелл по длине гифы; ЛВ — лнпнды и вакуоли; С — супернатант (цитоплазма); Я — ядра; М — митохондрии; Эр — эндоплазматический ретикулум и рибосомы; Г — гликогеи; 2 — реакция Паулн на протеины; 3 — реакция Сакагучн на протеины (аргинин); 4 — реакция Барнетта и Зелигмаиа (на ЭН-связн протеинов); 5 — окраска РНК (акридин — оранж); 6 — окраска ДНК ядер по Хюбшманну (азурА — 02); 7 — реакция Бауэра на гликоген; в — реакция Гочкнса ва углеводы (перйодат — Шнфф); 9 — реакция на жиры (судаи IV); 10 — окраска на липиды (тетраксид осмия); (по М. 2а1окаг, 1965)
м
|
м |
![]()
|
Эр |
![]() ш
ш
|
|
|
2[сГ |
|
■?[о" |
|
«Го" |
|
5~[о~ ^Го- |
Рис. 7.14. Схематическое изображение результатов цитохимического анализа распределения ферментов в клеточных органеллах Ыеито^рога сга&а после центрифугирования мицелия (направление центробежной силы слева направо): 1 — распределение органелл по длине гифы их обозначения как на рис. 7.13); 2 — сукцииатдегидрогеназа (тетро — золий); 3 — цнтохромоксидаза (НАДН); 4 — пероксидаза (бензидин); 5 — пероксидаза (десятнмннутная); 6 — 0-галактозндаза; 7 — щелочная фосфатаза, реакция Гомори (адеиоэии-3-фосфат); 8 — щелочная фосфатаза (6-нафтилфосфат, диазо-синяя); 9 — кислая фосфатаза, реакция Гомори (глицерофосфат); 10 — кислая фосфатаза (а-наф* тнлфосфат, дназо-сннЯя) (по М. яаіокаг, 1965)
ется полосатым тельцем, фильтрующим устройством, составленным из стопок дисков или цилиндров полисахаридной природы. Все эти образования могут комбинироваться до формирования полной пробки, обеспечивающей наиболее герметичную изоляцию клетки (рис. 7.12/Камалетдинова, Васильев, 1982/рис. 11, 15).
Изолирующие и фильтрующие устройства имеют несомненное отношение к приспособительной онтогенетической дифференциации, которая так развита в царстве грибов.