Питание и обмен веществ у живых организмов были бы невозможны без специфических органических катализаторов — ферментов, и в особенности это касается организмов гетеротрофов, которые используют для своего питания сложные органические соединения, находящиеся в окружающей их среде. Эти органические соединения очень часто, если не в большинстве случаев, представляют собой нерастворимые в воде полимеры, которые необходимо при их использовании расщепить на отдельные молекулы — мономеры. Для этого требуется широко развитая способность выделять в окружающую среду экзоферменты, приспособленные к находящемуся в ней субстрату. Другими словами, гетеротрофным организмам необходимо обладать способностью изменять в зависимости от условий среды качественный и количественный состав синтезируемого ими комплекса ферментов.
Ферменты не распределены равномерно по всей клетке, а » большинстве случаев связаны с определенными ее структурами. Это показали уже самые первые опыты по суперцентрифугированию клеточных гомогенатов. При этом нижний слой гомогената* содержащий митохондрии, показал в аппарате Варбурга поглощение кислорода, измеряемое 2500 условными единицами, средний, слой, содержащий рибосомы — 60 единицами, а у не содержащего субклеточных структур верхнего слоя поглощение кислорода отсутствовало полностью. Такой прозрачный цитоплазматический1 слой обычно содержит только гидролитические ферменты и большую часть ферментов путей гликолиза, тогда как ферменты цикла Кребса, дыхательной цепи и большинство синтетаз содержатся в митохондриях, микросомах, рибосомах, мембранах и в ядрах клеток. Гидролитических ферментов может оказаться больше, чем » клетке, в окружающей среде, куда они интенсивно выделяются.
Однако чаще это происходит не сразу после их биосинтеза* сопровождающего рост продуцента. Первоначально они накапливаются в мицелии, как связанные в цитоплазматической мембране. Участвующие в их биосинтезе связки рибосом и соответствующая информационная РНК локализуются на внутренней стороне плазматической мембраны (рис. 6.1). Формируемый ими фермент локализуется внутри нее и представляет собой в это время высокомолекулярный фосфолипопротеин, содержащий одновременно ли — пофильную и гидрофильную с терминальной ЫН2-группой цепи* способствующие ее транспортировке через мембрану. Окончательно сформированный энзим попадает далее в периплазматические пузырьки — мезосомы, причем его молекулярная масса падает в ~20 раз, видимо, за счет потери транспортных устройств, отщеп
ляемых эндопептидазами. Энзим принимает при этом форму энзи — матически активного глобулярного белка и транспортируется на наружную поверхность мембраны и в окружающую среду (Воте, 1981).
|
Я |
![]()
|
ч’Л з I |
![]() Сложный процесс синтеза и транспорта таких энзимов, естественно, разобщает во времени сопровождающий рост общий биосинтез белков и выделение и накопление гидролаз в культуральной среде. Именно с этим связано наблюдаемое у грибов резкое различие в длительности жизни информационной РНК, кодирующей биосинтез секреторных гидролаз, по сравнению с кодирующей внутриклеточные энзимы, что, вероятно, зависит от течения формирования секреторных энзимов в мембрано-связанном состоянии.
Сложный процесс синтеза и транспорта таких энзимов, естественно, разобщает во времени сопровождающий рост общий биосинтез белков и выделение и накопление гидролаз в культуральной среде. Именно с этим связано наблюдаемое у грибов резкое различие в длительности жизни информационной РНК, кодирующей биосинтез секреторных гидролаз, по сравнению с кодирующей внутриклеточные энзимы, что, вероятно, зависит от течения формирования секреторных энзимов в мембрано-связанном состоянии.
|
С£!- С£! С6 |
|
ъ |
![]()
|
ъ’ |
![]()
|
И-РНК |
|
О |
![]() Связанное с полимерами мембран состояние способствует сохранности стабильности не только кодирующей синтез ферментов информационной РНК, но и самих энзимов, что в последнее время широко используется для их стабилизации.
Связанное с полимерами мембран состояние способствует сохранности стабильности не только кодирующей синтез ферментов информационной РНК, но и самих энзимов, что в последнее время широко используется для их стабилизации.
|
О |
![]()
|
Рис. 6.1. Гипотетическая модель синтеза и секреции экзоэнзима. Сигнальный кодой ииформациоииой РНК обозначен как область зигзага, сигнальиаи последовательность в начале нативного протеина — как пунктирная линия. Направо — изменение конформации и выделение через клеточную мембраиу в среду синтезированного энзима (Воте, 1981) |
 Среди ферментов различают конститутивные, формирующиеся с самого начала онтогенеза, и адаптивные, появляющиеся впоследствии в зависимости от условий окружающей среды. В случае гидролитических адаптивных ферментов, расщепляющих высокомолекулярные субстраты (полисахариды, белки и т. п.), индукторами их появления могут быть либо их субстраты, либо иногда мономерные продукты производимых ими реакций. Последнее отмечалось для некоторых ферментов, гидролизующих полисахариды, например, индуктором некоторых пектиназ является галактуроновая кислота. Субстрат реакции нередко индуцирует также формирование ферментов, участвующих в детоксикации. Так, принадлежащий к эстеразам фермент трихотециназа начинает образовываться у почвенных грибов при наличии в среде субтоксических доз антибиотика три — хотецина.
Среди ферментов различают конститутивные, формирующиеся с самого начала онтогенеза, и адаптивные, появляющиеся впоследствии в зависимости от условий окружающей среды. В случае гидролитических адаптивных ферментов, расщепляющих высокомолекулярные субстраты (полисахариды, белки и т. п.), индукторами их появления могут быть либо их субстраты, либо иногда мономерные продукты производимых ими реакций. Последнее отмечалось для некоторых ферментов, гидролизующих полисахариды, например, индуктором некоторых пектиназ является галактуроновая кислота. Субстрат реакции нередко индуцирует также формирование ферментов, участвующих в детоксикации. Так, принадлежащий к эстеразам фермент трихотециназа начинает образовываться у почвенных грибов при наличии в среде субтоксических доз антибиотика три — хотецина.
Даже конститутивные энзимы, к которым относится большинство ферментов основного обмена, в онтогенезе грибов формируются не сразу, а в определенной последовательности, и кроме того, набор их в зависимости от возраста культуры сильно меняется как
по количественным соотношениям, так и качественно. Это можно — видеть из целого ряда примеров, часть из которых уже приводилась при обсуждении путей гликолиза у грибов. Было установлено, что изменения в наборе дыхательных энзимов, включающих гексо — киназу, глицеральдегид-3-фосфатдегидрогеназу, дегидрогеназы кислот цикла Кребса и ряд других, и в их активности наблюдаются уже при прорастании спор ряда плесневых грибов, как Tricho — derma viride, Aspergillus niger, Pйnicillium atrovenatum, P. oxali — cum. В процессе образования ростовых трубок активность ряда ферментов, особенно имеющих в качестве кофермента НАД, возрастала в 51—200 раз.
Аналогичная картина наблюдалась при развитии у грибов органов плодоношения. При развитии шляпки плодовых тел Schizo — phyllum commune в ней значительно возрастала активность R-глю — каназы, расщепляющей содержащийся в оболочках его клеток полисахарид с одной-тремя связями мономеров глюкозы, R-глюкан. Особенно активизировался этот адаптивный энзим при недостатке в среде глюкозы (Wessels, 1966). Активность многих ферментов меняется не только на протяжении всего онтогенеза или его узловых этапов, но и при таких краткосрочных периодических процессах, как деление клеточных ядер. Так, у базидиомицета Clavatia cyatiformis в гифах, находящихся в состоянии мейоза (редукционного деления), резко возрастала активность фосфатазы (Blumer, Li-Yu-Ten, 1966). Сильно изменялось также содержание окислительных и других ферментов в процессе развития мицелия Pйnicillium chrysogenum при ферментации пенициллина (Маттисон, 1956) и концентрация амилазы в погруженной культуре Aspergillus niger. Примеры подобного рода могут быть значительно расширены.
|
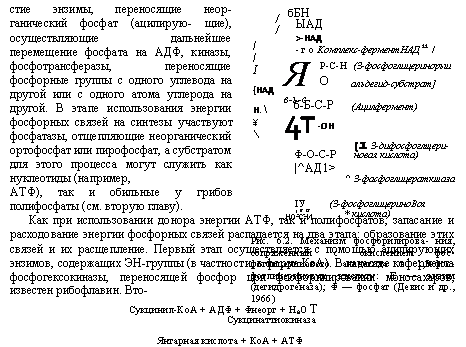
стие энзимы, переносящие неорганический фосфат (ацилирую — щие), осуществляющие дальнейшее перемещение фосфата на АДФ, киназы, фосфотрансферазы, переносящие фосфорные группы с одного углевода на другой или с одного атома углерода на другой. В этапе использования энергии фосфорных связей на синтезы участвуют фосфатазы, отщепляющие неорганический ортофосфат или пирофосфат, а субстратом для этого процесса могут служить как нуклеотиды (например, АТФ), так и обильные у грибов полифосфаты (см. вторую главу). Как при использовании донора энергии АТФ, так и полифосфатов, запасание и расходование энергии фосфорных связей распадается на два этапа: образование этих связей и их расщепление. Первый этап осуществляется с помощью ацилирующих энзимов, содержащих ЭН-группы (в частности, в форме КоА). В качестве кофермента фосфогексокиназы, переносящей фосфор цри фосфорилировании моносахаров, известен рибофлавин. Вто- Сукцинил-КоА + АДФ + Фнеорг + НаО Т Сукцинаттиокиназа Янтарная кислота + КоА + АТФ Рис. 6.3. Фосфорилирование АДФ в цикле Кребса (Девис и др., 1966) |
|
бБН |
|
/ / |
|
ЫАД >-НАД — г о Комплекс-ферментНАД 11 / Р-С-Н (3-фосфоглицеринорыи О |
|
/ / I {НАДН. |
|
Я в-ь-с- 4т |
|
альдегид-субстрат] (Ацилфермент) |
|
б-Б-С-Р — ОН |
|
(1 3-дифосфоглщери — новая кислота) |
|
Ф-О-С-Р |^АД1> ^ 3-фасфоглицераткшаза IУ (3-фосфоглицериноВоя ‘-г-а * кислота) |
|
но-с-и |
|
Рис. 6.2. Механизм фосфорилирова — ния, сопряженный с окислением фос- фоглицерииового альдегида в 1,3-фос — фоглицериновую кислоту: Е — энзим (дегидрогеназа); Ф — фосфат (Девис и др., 1966) |
|
|
 |
|
|
Эти ферменты применяются, в частности, для отщепления фосфата от тиаминпирофосфата при анализе тиамина и расщеплении фосфорилированного НАД при анализе витамина PP. Фосфатазы относятся к эстеразам, гидролизующим эфиры фосфорной кислоты. Сюда относят ферменты, гидролизующие эфиры фосфорной кислоты с углеводами, глицерофосфатазу, апиразу, расщепляющую АТФ, пирофосфатазу, метафосфатазу и другие полифосфата — зы. У грибов полифосфатаза впервые была найдена Манном у Aspergillus niger.
В дальнейшем, при изучении этого типа энзимов у Pйnicillium chrysogenum, были найдены апираза, расщепляющая АТФ, пиро — фосфатаза и метафосфатаза, которые все подавлялись ионами кальция, цинка и магния при pH от 3,0 до 5,0, а также фторидами и азидом. Глицерофосфатаза P. chrysogenum изучалась Садасива — ном, который обнаружил, что их имеется две (Sadasivan, 1965): щелочная с оптимальным pH от 8,0 до 9,0, содержащая магний и цинк, и кислая с оптимумом действия в кислом диапазоне pH. Щелочная фосфатаза сильно угнеталась синильной кислотой и кальцием и реактивировалась магнием и цинком, кислая реагировала на синильную кислоту значительно слабее.
У некоторых плесневых грибов, а именно у Pйnicillium lilaci — пит, Aspergillus oryzae, A. niger и Rhizoctonia violacea, фосфатаза образовывалась и даже стимулировалась при недостатке магния в среде. Однако при введении в среду возможного конкурента магния — бериллия — у испытанных видов рода Aspergillus наблюдалось подавление синтеза этого фермента, хотя у других двух видов — P. lilacinum и R. violacea — на первых стадиях развития его активность усиливалась.
Фосфатазы проявляют высокую активность в процессе деления клеток, что было отмечено как для процессов редукционного деления на примере базидиомицета Clavatia cyatiformis (Blumer, Li — Yu-Ten, 1966), так и для обычного кариокинеза у целого ряда паразитных и сапротрофных грибов.
При рассмотрении фосфорного обмена у высших эукариот, растений и животных основное внимание уделяется реакциям, в которых принимает участие как донор фосфора и энергии аденозинтри — фосфат. Однако низшие эукариоты (грибы, водоросли, протисты) и прокариоты (бактерии, актиномицеты и цианобактерии) имеют и другие, видимо, еще более значимые для их метаболизма, чем АТФ, доноры фосфора и энергии, а именно пирофосфат и неорганические высокополимерные полифосфаты. Поэтому ферменты грибов, имеющие отношение к их обмену, заслуживают специального рассмотрения (Кулаев, 1975).
Такие ферменты делятся на две категории: 1) имеющие отношение к их биосинтезу и 2) функционирующие при их использовании на нужды обмена веществ. Известны два фермента, производящие наращивание цепи полифосфатов на один фрагмент, а именно полифосфаткиназа и 1,3-дифосфоглицерат-полифосфат- трансфераза (ДФГК/рис. 6.4). Полифосфаткиназа наращивает по — лифосфатную цепь на один фрагмент за счет трансформации АТФ в АДФ. Однако направление действия полифосфаткиназы в сторону синтеза полифосфата известно только у бактерий, тогда как грибы (Aspergillus niger, Saccharomyces cerevisiae) способны только к необратимой реакции переброса фосфорной группы с полифосфата на АДФ, т. е. насыщению фосфором пула АДФ-*-АТФ. У ряда грибов (Neurospora crassa, Pйnicillium chrysogenum) не было обнаружено даже в этой реакции. Напротив, у всех иссле-
1. Полифосфаткнназа:
У бактерий АТФ + ПФ„ -» АДФ + ПФП+,
У бактерий и грибов
2. 1,3-дифосфоглицерат-полифосфаттраксфераза (ДФГ-ПФТ)г
СОО ~ (Р) У грибов и СООН
TOC o "1-5" h z | бактерий |
СНОН + ПФ„ , СНОН 4- ПФ„+1
СНгО —(Р) СНгО —(Р)
Рис. 6.4. Реакции полифосфат-синтезирующих фрементов у бактерий и грибов (Кулаев, 1975)
дованных бактерий она существовала и была обратимой, хотя и здесь, судя по максимальному развитию этой активности в конце онтогенеза бактерий, его основная роль приурочена к моменту максимального расхода полифосфатов и обогащения пула АТФ (Кулаев, 1975).
Второй фермент, 1,3-дифосфоглицератполифосфаттрансфераза (ДФГ-ПФК), наращивающий полифосфатную цепь за счет переноса фосфата с 1,3-дифосфоглицериновой кислоты, был найден первоначально у аденин-дефицитного мутанта Neurospora crassa, но затем и у дикого штамма этого гриба, у Pйnicillium chrysogenum и у ряда бактерий и актиномицетов. При наличии альдолазы субстратом действия этого фермента может служить также и 1,6- фруктозодифосфат. Он ингибируется известными ингибиторами гликолиза по пути ЭМП как монойодуксусная кислота или смесь фторида и арсенита, что говорит о тесной связи этого пути биосинтеза полифосфатов с циклом ЭМП. О том же говорят данные цитохимических исследований онтогенеза грибов, подтверждающие связь у них синтеза полифосфатов с этим путем обмена (Дмитриева, Беккер и др., 1962). Судя по максимальной активности этого фермента в период наиболее интенсивного наращивания пула полифосфатов, именно он, а не полифосфаткиназа является наиболее вероятным агентом биосинтеза полифосфатов.
На основе первых изотопных исследований предположили, что различные фракции полифосфатов образуются за счет деградации полифосфатдеполимеразами первично синтезированных наиболее высокомолекулярных фракций, что, в общем, соответствует истине, хотя, возможно, объясняется локализацией этих деполимераз в зоне действия синтезирующих полифосфаты ферментов в области клеточной мембраны и зоны поступления из среды ортофосфата. Однако позднее было обнаружено, что эти фракции могут синтезироваться и независимо друг от друга. Например, у базидиоми — цета Lert/trtыs Ицпаиэ и аскомицета кеигоБрога сгаББа была обнаружена корреляция накопления солерастворимой фракции полифосфатов (ПФ2) с биосинтезом РНК и ДНК на уровне коэффициента корреляции, равном 0,88. Подтверждение объяснения этого явления было получено при исследовании на БсЫгозассНаготусез ротЬе.
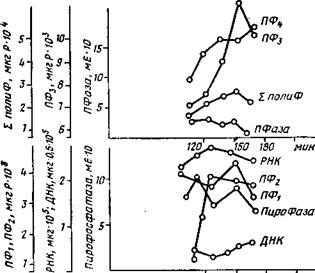
Максимум активности предположительно участвующей в снабжении энергией биосинтеза полифосфатов пирофосфатазы опережает максимум накопления нуклеиновых кислот и ПФ2 фракции
|
Рис. 6.5. Динамика изменения содержания нуклеиновых кислот, полифосфатов, полифосфатфосфогидролазы (ПФаза) и пирофосфатазы (ПироФаза) у БсЫго — засскаготусез pom. be. ПФ1 и ПФа, — кислоторастворимые и солерастворимые полифосфаты; ПФ3> ПФ4 и 2ПолиФ — щелочерастворимые, растворимые в горячей хлорной кислоте и сумма всех полифосфатов (Кулаев, 1975) 120 ISO WO 210 MUH |
(рис. 6.5). Предположительная схема этого процесса приводится на рис. 6.6.
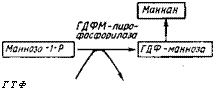
Сходный механизм с участием той же пирофосфатазы предположительно объясняет корреляцию накопления фракции полифосфатов ПФ3 с синтезом маннана, компонента оболочки дрожжей Saccharomyces carlsbergietisis (рис. 6.7).
Необходимы ли для синтеза полифосфатов какие-либо матричные основы или затравки пока неясно, но есть данные, что для него требуются затравки в форме три-, тетра — и других полифосфатов. Существенно, что вторичный синтез полифосфатов действи-
|
РНК (ДНИ) полимераза |
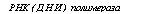 АТФ
АТФ
|
РНК(ДНК) |
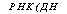 ГТФ
ГТФ
ЦТФ
УТФ (ТТФ)
(п) Пиросроссрат Полафосфат (т)
Пиросросфатаза (?)]
(п-1) Пирофосфат * Ортофосфат Полифосфат (т*1)
Рис. 6.6. Схема сопряженного синтеза полифосфатов и биосинтеза РНК и ДНК
(Кулаев, 1975)
тельно имеет место у грибов, локализуясь в местах усиленного биосинтеза (клеточная мембрана, ядро) с использованием энергии и ортофосфата от расщепления освобождающегося при этих биосинтезах пирофосфата.
Низкополимерные пирофосфаты могут образовываться путем следующих реакций, характер которых показан в табл. 6.1. При
|
ГТФ |
|
Пиросросфат Рис. 6.7. Схема, объясняющая корреляцию накопления полифосфатов у Saccharomyces carlsbergiensis (Кулаев, 1975) |
 этом триполифосфаты могут ■быть продуктом действия деполимераз, синтезироваться из пирофосфата и фрагмента фосфорной кислоты, отщепляемого от АТФ, быть продуктом отщепления трехфрагментного остатка фосфатов от нуклеозид трифосфата, получаться при образовании из АТФ и метионина Э-аденозилметионина и, наконец, образовываться в процессе биосинтеза витамина В12. Для биосинтеза тетраполифосфата (см. табл. 6.1) известна реакция, основанная на разрыве циклической структуры
этом триполифосфаты могут ■быть продуктом действия деполимераз, синтезироваться из пирофосфата и фрагмента фосфорной кислоты, отщепляемого от АТФ, быть продуктом отщепления трехфрагментного остатка фосфатов от нуклеозид трифосфата, получаться при образовании из АТФ и метионина Э-аденозилметионина и, наконец, образовываться в процессе биосинтеза витамина В12. Для биосинтеза тетраполифосфата (см. табл. 6.1) известна реакция, основанная на разрыве циклической структуры
Способы образования триполифосфатов и тетраполифосфатов (Кулаев, 1975)
Образование триполифосфатов:
1. ПФ„——————————————————— »-3-ПФ+ПФ„_3.
2. Пирофосфат+АТФ у "З-ПФ+АДФ.
3. Нуклеозидпирофосфат —————————————- *-нуклеозид+ 3-ПФ.
4. АТФ+метионин ^-аденозилметионин+З-ПФ.
восстановленный флавин
5. АТФ + цианкобаламин, ’5-прлокг. иапр. но.'{илкобалямин4-
+ СЫ — + 3-ПФ.
Образование тетраполифосфата:
Триметафосфат (циклический) + ортофосфат———————————————————- М-ПФ.
триметафосфата с включением в полученную цепь одного фрагмента ортофосфата (Кулаев, 1975). Реакция трансформации циклического полифосфата в линейный была обнаружена у дрожжей.
Таким образом, значительную роль в биосинтезе полифосфатов играет пирофосфат, образование которого у грибов может быть результатом не только процессов биосинтеза нуклеиновых кислот или полисахаридов, но и еще ряда реакций (табл. 6.2). Суммар-
Таблица 6.2
Пути образования пирофосфата у грибов (Кулаев, 1975)
»
Суммарная реакция:
Пирофосфорил-А + В ’ А-В + пирофосфат.
1. Нуклеотидилтрансферазы:
1. Нуклеозид-ТФ+Х , ■ ~*’нуклеозид-МФХ+пипосЬоссЬят
(где Х=аминокислота, жирная кислота или моносахарид и т. п.).
2. Фосфорибозилтрансферазы:
б’-фосфорибозилпирофосфат + У 1 ~|~У-Рибозил-5′-ФосФат + пирофпсфат
(где У=азотистое основание).
ная реакция состоит в сочетании между собой соединений А и В с потерей первым из них пирофосфата, отщепление которого сопровождается выделением энергии, необходимой для этой реакции. К производящим подобные реакции ферментам относятся нуклеотидилтрансферазы, ацилирующие нуклеозидтрифосфаты с образованием нуклеозидмонофосфатов аминокислот, сахаров или фрагментов жирных кислот, и фосфорибозилтрансферазы, переносящие 5′-фосфорибозильную группу на различные азотистые основания.
Кроме того, у дрожжей описана третья реакция, также дающая в качестве конечного продукта пирофосфат и состоящая в отщеплении фосфорной группы от высокомолекулярного полифосфата,
конденсирующейся далее с одной молекулой ортофосфата. Однако дальнейшая проверка наличия производящего такую реакцию фермента у Saccharomyces cerevisiae, Endomyces magnusii и Neu — rospora crassa не позволила подтвердить его существование.
Поскольку полифосфаты у грибов являются специализированными донорами фосфора и энергии для биосинтеза различных клеточных структур, в их обмене помимо синтезирующих имеют значение ферменты, производящие их деградацию и гидролиз. Уже упоминалось о роли в этих процессах полифосфаткиназы бактерий, переносящей фосфорную группу с АТФ на полифосфаты при их синтезе и обратно с полифосфатов на АДФ при их использовании. Первая реакция свойственна только бактериям, тогда как вторая обнаруживается также и у некоторых грибов.
На ферментах этого типа наиболее ярко обнаруживаются особенности биохимической эволюции грибов и прокариот (бактерий и актиномицетов), подтверждающие мнение о различном их происхождении и экологической конвергентности их морфологических признаков, например сходства спороношений грибов и актиномицетов. Так, помимо различно ведущей себя у грибов и бактерий полифосфаткиназы у бактерий и актиномицетов обнаружен отсутствующий у всех испытанных представителей грибов из классов сумчатых, базидиальных, дейтеромицетов и зигомицетов фермент полифосфатглюкокиназа, фосфорилирующий глюкозу за счет отщепления концевого фрагмента полифосфатов. Этот фермент имеет узкое значение даже для прокариот, так как обнаруживается только у их представителей, относимых Красильниковым к классу актиномицетов (актиномицеты, микобактерии, коринебактерии, про — пионобактерии, микрококки и т. д.), что может говорить в пользу их самостоятельной филогении, происходящей от иного корня, чем у Eubacteria. То же относится и к таким переносящим фосфат ферментам, как полифосфатфруктокиназа, полифосфатманнокиназа и полифосфатглюконаткиназа, которые также встречаются только у бактерий (Кулаев, 1975).
У грибов, видимо, широко развита дифференцированная в отношении разных фракций полифосфатов система полифосфатаз, сре-
Таблица 6.3
Ферменты грибов и бактерий, расщепляющие полифосфаты (1 — полифосфатазы с оптимумом pH 7,1—7,5 / Кулаев, 1975)
1. Полифосфатазы (полифосфатфосфогидролазы):
|
ПФл-1 + ортофосфат. |
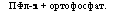 ПФд+НгО
ПФд+НгО
2. Олигополифосфатазы:
а) тетраполифосфатаза: 4-ПФ + НгО —
б) триполифосфатаза: З-ПФ + НгО ———
в) пирофосфатаза (бактерии и грибы):
‘ -►3-ПФ + ортофосфат. *тшрофосфат+ортофосфат.
|
пирофосфат + НгО |
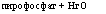 ■2 молекулы ортофосфата.
■2 молекулы ортофосфата.
ди которых различают категорию полифосфатфосфогидролаз, экзоферментов, гидролизующих с отщеплением концевого остатка фосфорной кислоты с образованием ортофосфата и имеющих оптимум pH в нейтральной зоне (pH 7,1 —7,5, табл. 6.3).
|
Рис. 6.8. Влияние катионов на активность полифосфатфосфогидролазы Endo — myces magnusii (Кулаев, 1975) |
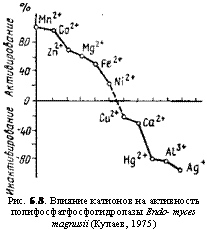 К этой категории относятся: 1) полифосфатазы, гидролизующие высокомолекулярные пирофосфаты; 2) олигополифос — фатазы, гидролизующие тетра-, триполифосфаты и пирофосфат. Ферменты этого типа, обнаруженные кроме бактерий у Saccharomyces cerevisiae, Еп — domyces magnusii и Neurospo — ra crassa, обычно встречаются в форме комплекса. Так, среди комплекса ферментов этого типа у N. crassa выявляются одновременно присутствие полифосфатазы, трипо- лифосфатазы, пирофосфатазы и АТФ-азы. Ферменты этой группы являются металлофер- ментами, стимулируемыми или: ингибируемыми двухвалентными катионами металлов, как это можно видеть на примере полифосфатгидролазы E. magnusii на рис. 6.8. Однако действие катионов на активность этих ферментов у разных грибов оказывается
К этой категории относятся: 1) полифосфатазы, гидролизующие высокомолекулярные пирофосфаты; 2) олигополифос — фатазы, гидролизующие тетра-, триполифосфаты и пирофосфат. Ферменты этого типа, обнаруженные кроме бактерий у Saccharomyces cerevisiae, Еп — domyces magnusii и Neurospo — ra crassa, обычно встречаются в форме комплекса. Так, среди комплекса ферментов этого типа у N. crassa выявляются одновременно присутствие полифосфатазы, трипо- лифосфатазы, пирофосфатазы и АТФ-азы. Ферменты этой группы являются металлофер- ментами, стимулируемыми или: ингибируемыми двухвалентными катионами металлов, как это можно видеть на примере полифосфатгидролазы E. magnusii на рис. 6.8. Однако действие катионов на активность этих ферментов у разных грибов оказывается
— Таблица 6.4
|
Удельная активность полифосфатазы в клетках и их органеллах (Кулаев, 1975)
|
 различным. Так, фермент из N. сгазза активируют магний, кобальт, марганец и железо, тогда как для фермента из Е. magnu. sU наиболее эффективны марганец и кобальт, а у дрожжей к магнию и кобальту добавляется никель, сильно угнетающий фермент N. сгаз — Ба. Подобная разнохарактерность действия катионов наблюдается и при рассмотрении их ингибирующего влияния.
различным. Так, фермент из N. сгазза активируют магний, кобальт, марганец и железо, тогда как для фермента из Е. magnu. sU наиболее эффективны марганец и кобальт, а у дрожжей к магнию и кобальту добавляется никель, сильно угнетающий фермент N. сгаз — Ба. Подобная разнохарактерность действия катионов наблюдается и при рассмотрении их ингибирующего влияния.
Вероятно, вся эта пестрота эффектов зависит от катионов, действующих как на сам фермент, так и на субстраты реакции, с которыми они образуют комплексы, способствующие облегчению или угнетению степени атта — куемости связи —О—Р—О—Р.
Полифосфатазы грибов, как видно из табл. 6.4, локализуются в основном на поверхности клетки, близ локализации высокополи
мерных полифосфатов, вместе с которыми они вымываются из мембраны после обработки клеток улиточным ферментом.
Вторая категория подобных же ферментов грибов представляет собой эндоформы или деполимеразы, расщепляющие цепи полифосфатов с образованием олигополифосфатов или полифосфатных
Таблица 6.5
Ферменты грибов, расщепляющие полифосфаты. Полифосфат — деполимеразы (полифосфатполифосфогидролазы) с оптимальным pH 3,2—3,4, встречающиеся только у грибов (Кулаев, 1975)
Полифосфатполифосфогидролазы.
Тип реакции: ПФ(т+„) + НгО———————— ► ПФт + ПФ„
|
Табл и ца 6.6 |
|
Внутриклеточная локализация полифосфатдеполимеразиой активности у Neurospora сгаььа в мЕ/мг белка -(Кулаев, 1975)
|
 цепей меньшей длины, чем исходная. Тип такой реакции показан в табл. 6.5, а результат ее обычно замеряется вискозиметрически. Ферменты этого типа характерны оптимумом в заметно кислой зоне pH (3,2—3,4). Они также активируются металлами, особенно цинком.
цепей меньшей длины, чем исходная. Тип такой реакции показан в табл. 6.5, а результат ее обычно замеряется вискозиметрически. Ферменты этого типа характерны оптимумом в заметно кислой зоне pH (3,2—3,4). Они также активируются металлами, особенно цинком.
Локализация деполимераз еще в большей степени, чем у нейтральных полифосфатаз, привязана к поверхности клеточной мембраны, поскольку освобожденные от оболочки протопласты сохраняют их активность в размере порядка только около 0,1 от первоначальной (табл. 6.6). Есть основания предполагать, что эта категория энзимов может участвовать в переносе с поверхности клеточных мембран фрагментов синтезированных на них полифосфатов к другим клеточным структурам, работая таким образом как фосфотрансфе — разы. Регуляция действия всех описанных ферментов обмена полифосфатов очень сильно зависит от баланса соотношений полифосфатов и ортофосфата, являющегося основным механизмом, регулирующим направление их действия.