Гидролазами называют ферменты, катализирующие расщепление субстрата на его компоненты с присоединением к ним воды, и у грибов это часто бывают экзоферменты, выделяющиеся в окружающую среду. В их число входят карбогидразы, расщепляющие белки и пептиды, различные олиго — и полисахариды, протеолити-
ческие ферменты, расщепляющие белки и пептиды, к которым примыкают кератинолитические, разрушающие кератин рога, шерсти и перьев, фибринолитические, гидролизующие фибрин крови, а также расщепляющие фосфорные и другие сложноэфирные связи эстеразы, среди которых различают гидролизующие жиры липазы, фосфолипазы и рассмотренные выше фосфатазы.
Липазы и фосфолипазы[6]. Липазы относятся к числу гидролитических ферментов из категории эстераз, расщепляющих жиры, которыми весьма богаты многие грибы, использующие жиры как источник углерода. Липазы обильно встречаются у многих почвенных, плесневых и паразитных грибов.
Реакция, производимая грибными липазами, большей частью состоит в отщеплении от глицеридов жирных кислот, находящихся в положении С-1 или С-3 атомов глицерина (табл. 6.7) в последовательном порядке от С-3 к С-1 ацильным группам.
Т а б л и ц а 6.7
Катализируемая грибной липазой деградация триацилглицерида (Veete, 1980)]
1,2,3-триацил глицерид 1,2-диацил глицерид + жирная кислота 2-моноацилглицерид + жирная кислота глицерин + жирная’кислота
Для отщепления последней ацильной группы в положении С-2 необходима изомеризация, переводящая ее в положение С-1 или С-3. Это осуществляется грибами, поскольку они почти всегда способны к полному деацилированию триглицеридов. Однако у некоторых форм, например у Aspergillus flavus, такой позиционной специфичности нет, а у Geotrichum candidum специфичность проявляется в приуроченности к ненасыщенным жирным кислотам со структурой А9 независимо от их положения в отношении атомов углерода глицерина. Это наиболее специфичная из всех липаз грибов.
У Saccharomyces cerevisiae липаза связана с клеточной мембраной и изолируется из нее при переваривании клеточной оболочки. Большей частью липазы грибов относительно стабильны и имеют оптимум действия при pH 8,0. Скорость гидролиза липазой триглицеридов по положению С-1 у Mucor javanicus выше, чем диглицеридов по положениям С-1, С-3, вероятно, потому, что диглицериды менее электрофильны, и она падает в направлении: три — глицериды-»-С-2, С-3-диглицериды-*моноглицериды. Быстрее гидролизуются также триглицериды, содержащие олеиновую и
линолевую жирные кислоты, чем линоленовую, вероятно, в результате изменения под ее влиянием конфигурации триглицерида вследствие обилия двойных связей и затруднения образования его комплекса с энзимом.
Образование липаз грибами — важный элемент процесса сыроварения с применением грибных заквасок на основе Pйnicillium roquefortii и P. kamemberti. Острый вкус мягких сыров типа рокфора зависит в значительной мере от свободных жирных кислот, вторично образующихся сложных эфиров и альдегидов, являющихся конечными продуктами процессов, катализируемых липазами.
Виды грибов, обильно образующие липазы, обычно являются виновниками прогоркания масел или порчи масличных семян (Eggins, Coursey, 1968), туалетного мыла, коррозии и закупорки масляных и топливных баков, маслопроводов авиационных моторов, что приводило даже к воздушным катастрофам. Порча грибами произведений живописи с использованием масляных красок тоже зависит от разрушающих способностей этих грибов, обильно выделяющих липолитические ферменты (Курицына, 1968).
|
Рис. 6.9. Места действия на фосфолипиды фосфолипаз А), Аг, В, С и Д (Weete, 1980) |
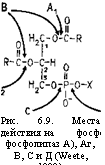 Фосфолипазы, гидролизующие фосфолипиды, изучались у немногих грибов. Всего насчитывают порядка пяти таких энзимов, обозначаемых как Аь А2, В, С и Д (рис. 6.9) и отличающихся по местам производимого ими гидролиза (We — ete, 1980). Фосфолипазы А] и А2 катализируют отщепление ацилированных жирных кислот по положению С-1 (Aj) и С-2 (А2).
Фосфолипазы, гидролизующие фосфолипиды, изучались у немногих грибов. Всего насчитывают порядка пяти таких энзимов, обозначаемых как Аь А2, В, С и Д (рис. 6.9) и отличающихся по местам производимого ими гидролиза (We — ete, 1980). Фосфолипазы А] и А2 катализируют отщепление ацилированных жирных кислот по положению С-1 (Aj) и С-2 (А2).
Эти реакции способна производить также фоефолипаза В. Фосфолипазы С и Д являются собственно фосфатазами, так как они отщепляют фосфорную кислоту по ее —Р—О— связям, первая в месте контакта с С-3 атомом глицерина, а вторая с основанием, например с холином или этанола- мином. Соответственно продуктами этих реакций оказываются в первом случае фос- форилированное основание (например, фос — фатидилхолин), во втором одно основание (например, холин).
Обнаруженные у грибов фосфолипазы способны производить полное деацилирование 1,2-диацилглицерофосфатидов до глице — ро-3-фосфата и двух жирных кислот, а также до 1,2-диацилглице — рида и фосфорилированного основания (например, о-фосфатидил — холина) и являются широкоспецифичными. Фоефолипаза D была открыта только у растений.
Наиболее полно была исследована фоефолипаза из Pйnicillium notatum, активная в отношении диацилфосфолипидов и стимулируемая кардиолипином и фосфатидилинозитом. Фоефолипаза А была найдена в сухих дрожжах и гидролизовала фисфатидилхо — лин, трансформируя его в лизофосфатидилхолин и глицеро-3-фос-
фатидилхолин. Фосфолипаза В из Р. notatum активировалась анионами, возможно, вследствие участия их в диспергировании фосфолипидов в результате увеличения отрицательного потенциала субстрата. Это подтверждается возможностью их замены обработкой ультразвуком. Оптимальная активность фосфолипазы В из Р. notatum достигается при pH 4,0 и усиливается при введении —S—S— связей. Фосфолипаза В была также найдена у Sclerotium rolfsii и имела при этом оптимум действия при pH 4,5.
О нахождении фосфолипазы С было сообщено некоторыми авторами для дрожжей, бактерий Ervinia carotovora и некоторых фитопатогенных грибов. Необычный энзим с фосфолипазной активностью был найден у Rhisopus arrhizus, катализирующий гидролиз триацилглицеридов в положении С-1 и С-3. Сходный с энзимом Rhisopus фермент был обнаружен в панкреатической железе свиньи.
Карбогидразами называют ферменты, производящие сопровождаемое гидролизом расщепление углеродсодержащих безазотистых соединений, например, различной степени сложности углеводов. Поскольку именно такие субстраты чаще всего используются грибами как источник углерода, ферменты этого типа, образуемые ими, весьма обильны и разнообразны.
К ним относятся прежде всего ферменты, действующие на дисахариды, такие как инвертаза (или сахараза), расщепляющая сахарозу на фруктозу и глюкозу, трегалаза и мальтаза, делящие соответственно на две молекулы глюкозы трегалозу и мальтозу, и лактаза, расщепляющая на глюкозу и галактозу дисахарид лактозу. Ферменты этой категории, будучи широко распространены у грибов, имеются все же не у всех. Например, у Chaetoceratosto — та longirostre отсутствует инвертаза, и при росте без глюкозы, которая способствует образованию у нее красного пигмента, ее колония на среде с. сахарозой остается неокрашенной. Вследствие этого данный вид может служить тестом для обнаружения инвертазы у других грибов, в совместной культуре с которыми на среде с сахарозой его колония становится окрашенной пигментом, синтезируемым на базе глюкозы, образующейся в результате действия инвертазы культивируемого вместе с ним вида гриба.
Ферменты этого типа могут быть не только конститутивными, но и адаптивными. Например, у Saccharomyces fragilis таковым является инвертаза, образование которой усиливается очень резко на среде с сахарозой и которая почти не образуется на средах с рафинозой, лактозой или мелибиозой (Девис и др., 1966). У других дрожжей адаптивным ферментом является энзим, участвующий в усвоении галактозы, образование которого стимулируется выделенным из них термостабильным фактором.
Трегалаза, видимо, также является адаптивным ферментом у миксомицета Dictyostelium discoideum, постепенно накапливающимися у него в процессе прорастания спор (Cotter, Raper, 1966). Кроме миксомицета Dictyostelium трегалаза была также обнару-
|
f |
ceHa в мицелии и склероциях в культуре Sclerotinia sclerotiorum Wang-Sy-Jing, Le Tourneau, 1972). Очищенный фермент имел оптимальную активность в пределах pH около 5,0 и константу Ми — хаэлиса, равную 1,7• 10—3. Еще ранее трегалаза была также обнаружена у базидиомицета Schizophyllum commune (Williams, Nie — derpruem, 1968).
Некоторые дрожжи накапливают расщепляющие дисахариды ферменты в больших количествах, что позволяет использовать их в промышленных целях. Например, к числу таких видов относится Fabrospora fragilis, образующая Я-галактозидазу (лактазу) и оказавшаяся наиболее эффективной среди пятидесяти испытанных одновременно с ней штаммов дрожжей.
Олигосахариды с a-D-галактозным остатком, широко распространенные у растений и животных, гидролизуются а-галактозида — зой, встречающейся как среди дрожжей, так и нитчатых грибов. Среди 89 культур дрожжей, принадлежащих к 21 роду, она обнаружена только у двух испытанных видов рода Schwanniomyces, S. occidentalis и S. alluvius, причем наиболее активен был первый из этих видов, культивируемый на среде с молочной сывороткой (Улезло и др., 1980). Среди нитчатых дейтеромицетов хорошим продуцентом a-галактозидазы оказался штамм из рода Cephalos — porium (Cephalosporium sp. 237), из культуральной жидкости которого энзим осаждался этанолом или ацетоном и гидролизовал все три использованных субстрата: п-нитрофенил-а-0-галактопи — ранозид (гс-НФГ), к которому его сродство было наибольшим, ме — либиозу и рафинозу, но с оптимальной активностью при разных pH. Для гидролиза n-НФГ оптимальная активность находилась при pH 5,5, для мелибиозы — при pH 5,0 и для рафинозы — при pH 6,0. Препарат фермента содержал примеси протеазы и инвер — тазы, был стабилен в диапазоне pH от 5,0 до 9,0 и терял 40% активности в течение 10 мин при 50 °С. Для гидролиза субстрата n-НФГ оптимальная активность энзима наблюдалась при 40 °С (Запрометова и др., 1982).
Среди ферментов, расщепляющих сложные полисахариды, наиболее распространенным у грибов энзимом является амилаза. Она представляет собой, по существу, не один фермент, а комплекс энзимов, гидролизующих крахмал. В составе этого комплекса в настоящее время числятся (Яровенко, Устинников, 1975): 1) a-амилаза (по промышленной терминологии АС), гидролизующая крахмал по связям 1—4 до неокрашивающих;ся йодом декстринов, а также до мальтозы и глюкозы; 2) декстриназа (ДС), гидролизующая конечные декстрины до редуцирующих сахаров, иначе называемая олиго-1-б-глюкозидазой по ее способности расщеплять крахмал по 1-6-глюкозидным связям; 3) обнаруженная •Фениксовой и Шиловой (1964, 1970) в культуре Aspergillus awa — mori, а позднее и у многих других плесеней глюкоамилаза, гидролизующая крахмал до глюкозы как по связям а-1,4, так и по а-1,6 (ГА). К числу ферментов комплекса амилазы присоединяют обычно н мальтазу (MC).
Декстриназа помимо способности расщеплять крахмал по глюкозидным связям оказалась способной формировать из глюко/ зидных остатков изомальтозу, панозу, мальтотриозу и другие сходные сахара, т. е. обладала одновременно свойствами трарс — гликозилазы с общей схемой действия фермента:
Две молекулы мальтозы =г=ь мальтотриоза + глюкоза.
Фермент этого типа особенно характерен для серии вида Л$- pergillus niger (Л. niger, A. batatae, A. awamori), но имеется также и у Л. огугае, хотя последний характерен больше высокой активностью а-амилазы.
а-Амилаза грибов ингибируется тяжелыми металлами, а кальций является ее важным компонентом, стабилизирующим конформацию фермента. Она достаточно кислотоустойчива, так как сохраняет активность при pH 2,5 в течение 30 мин и имеет оптимальную активность при pH порядка 4,5—4,8. Большинство глюкоамилаз также действуют в кислой зоне pH (3,5—5,5), но у некоторых грибов, например у Saccharomyces italicus, встречаются нейтральные глюкоамилазы с активностью при pH от 6,0 до 7,5. Этот фермент способен гидролизовать даже 1-3-глюкозидные связи, и не только крахмал, но и конечные декстрины и гликоген. Он был обнаружен также у мукорового гриба Rhizopus delamar и у Endomycopsis sp. Температурные пределы его действия колеблются от 40 до 60° С.
Амилаза почти всегда является конститутивным ферментом, даже у дереворазрушающих грибов (Lyr, 1959b), и широко распространена в очень разнообразных таксойомических группах. Не содержат ее только некоторые оомицеты, например виды рода Phytophthora, выделяющие вместо нее вещества, индуцирующие биосинтез амилазы в пораженных ею клубнях картофеля. У почвенных плесневых грибов из родов Aspergillus и Pйnicillium амилаза — распространена особенно широко, и именно виды этих родов обычно служат ее источниками для промышленности. Комплексы ферментов, составляющих их систему, гидролизующую крахмал, даже у видов одного рода могут быть неодинаковыми, от чего зависит выбор разных продуцентов для различных практических целей. Например, у Aspergillus огугае преобладает а-амилаза с оптимумом активности при pH 5,0—5,4, тогда как группа Л. niger обычно богаче глюкоамилазой, декстриназой и мальтазой. Индуктором образования у Л. niger..амилазы является продукт гидролиза крахмала мальтоза, а глюкоза подавляет ее синтез.
Среди видов рода Ascochyta и у близкого к ней рода Phoma присутствуют одновременно и а-амилаза, и глюкоамилаза, и отдельные виды отличаются не столько по относительному их количеству, сколько по общему объему их продукции и скорости их формирования. Наиболее продуктивной оказалась в заданных условиях среды Ascochyta cucumeris, а наименее — Л. pisi и представитель рода Phoma, P. medicaginis (Решетникова, Успенская,
1981).
, Амилаза Penicilium chrysogenum подавлялась солями аммония, аактивировалась фенилуксусной кислотой и кукурузным экстрак — тбм и оказалась наиболее активной в нейтральной зоне pH от 6,4 до 7,0.
Близкому к амилазе ферменту, производящему гидролитическое расщепление инулина, было присвоено название инулазы, но> в данное время ферменты этого типа называют фруктангидрола — зами. Согласно ранним исследованиям инулаза является адаптивным ферментом, образуемым Aspergillus niger в основном при росте его на среде с инулином, но не на средах с глюкозой или. мальтозой. Название фруктангидролаз присвоено ферментам, приспособленным к субстратам, в состав которых (как, например,, в состав инулина) входит фруктоза. Фруктангидролаз различают три категории: 1) собственно инулазу, гидролизующую только* инулин; 2) менее специфичную гидролазу, расщепляющую кроме инулина леван и сахарозу; 3) леваназу, фруктангидролазу, расщепляющую только леван и освобождающую из него помимо- фруктозы ее олигосахариды (Элисашвили и др., 1980). Последняя оказалась полезной в стоматологии для профилактики и лечения кариеса.
Внеклеточную леваназу оказалось возможным получать из культуральной жидкости Fusarium solani 68 при помощи осаждения ее сульфатом аммония и гель-хроматографии на сефадексе G-150. Максимальная активность ее наблюдалась при pH 6,8, температуре 45° С и концентрации полисахарида 6,7 мг/мл. Фермент отличался стабильностью при pH от 5,0 до 7,5 и при 40—45 °С. Константа Михаэлиса для этого энзима была равна 1,5-10-6 М.
Комплекс ферментов, разрушающих клетчатку до целлобиозы и затем до глюкозы, носит общее название целлюлазы. Эффект ее действия в отношении древесины особенно ярко виден у грибов, возбудителей ее деструктивной гнили, при которой древесина теряет свою волокнистую структуру, буреет, растрескивается и легко растирается в порошок, что особенно характерно для поражения домовыми грибами — Serpula (Merulius) lacrymans, Со — niophora puteana (C. cerebella) и другими. Этапы разрушения древесины этими и другими грибами были тонко изучены на цитохимическом и электронно-микроскопическом уровне (Liese, Schmied, 1962; Liese, 1970; Peek et al„ 1972).
Уже более двадцати лет назад было установлено, что целлюлоза, как и амилаза, у большинства из ее продуцентов представлена комплексом из нескольких ферментов, свойства которых были, первоначально изучены (Jermyn, 1956) на модели дейтеромицета Stachybotrys atra, а позднее на других объектах (Selby, 1968). В итоге было установлено наличие у грибов комплекса из трех энзимов (рис. 6.10): 1) фактора набухания, вызывающего подготовку к дальнейшему расщеплению, и набухание высококристаллической целлюлозы, ПО-ВИДИМОМу, идентичного фактору Cl по классификации Селби; 2) термостабильной «вискозиметрической»- целлюлозы, эндоэнзима, разрушающего несколько более низкомо —
.лекулярную целлюлозу, понижая ее вязкость вследствие ее рас/ щепления на цепи меньшей длины. Конечными продуктами ее действия являются сначала олигосахариды, а потом целлобиоза’и глюкоза. Расщеплять целлобиозу она не может. Видимо, она идентична с С*-фактором по классификации Селби; 3) термолабильной р-глюкозидазы, экзоэнзима, расщепляющей [5-глюкозидную связь
Нативная целлюлоза
Сх компонент целлюлазы (вероятно «фактор набухания» по Джёрмену)
М = 30 000
Твдратированные полиангидридные——————————————————————
цепи целлюлозы
Сх компонент («вискози — Р-глюкозидаза
метрическая целлюлаза») (вероятно М = 5 300)
М = 55 000 (термолобильная)
|
Деллобиоза | Целлобиаза Т люкоза-<—————————————————————
|
|
Рис. 6.10. Схема последовательности действия целлюлитических ферментов и относительной их активности поодиночке и в смеси (Selby, 1968) |
концевого мономера глюкозы в цепи, которая является единственным продуктом действия этого фермента. Как и мальтаза в комплексе амилазы, в случае комплекса целлюлазы в него входит энзим целлобиаза, расщепляющий на две молекулы глюкозы составляющий клетчатку дисахарид целлобиозу (см. рис. 6.10).
Механизм действия ос — и (i-глкжозидаз, соответственно расщепляющих полимеры целлюлозы по ос — и [5-связям, изучался тем же Джермином (Jermyn, 1958) и, по его мнению, ои состоит в образовании тройного комплекса — энзим — донор — акцептор, где акцептором обычно является вода. При разрушении этого комплекса получается конечный продукт гидролиза — глюкоза. Молекулярная масса приведенных на рис. 6.10 энзимов согласуется с глубиной их действия. Она равна 55000 для «вискозиметрической» целлюлазы, 30 000 для фермента Ci (фактора набухания) и всего около 5300 для jj-глюкозидазы. В комплексе действие этих ферментов резко усиливается, как это видно из сравнения гидролитического эффекта компонентов комплекса поодиночке и совместно (см. рис. 6.10).
Продолжение изучения целлюлозолитических ферментов грибов в последнее время, проводившееся с привлечением продуцентов йз дейтеромицетов, в частности вида Geotrichum cand. id. um (Тиу — нова и др., 1982), показало наличие среди (}-глюканаз специализированных типов энзимов по отношению к определенным глюкозид — ным связям (1-3, 1-4 или 1-6). Использование в качестве субстрата ламинарина позволило выявить у G. candidum активность 1-3- р-глюканазы, пустулина — 1-6-р-глюканазы. Выявлялись также при росте в течение 75—100 ч 1-4-(}-глюканаза (С*-фермент), образующаяся после 70 ч роста (}-глюкозидаза, расщепляющая цел — лобиозу, и по расщеплению хлопкового волокна Срфермент Селби. Исследование р-глюканаз с помощью изоэлектрического фокусирования в градиенте pH показало, что все эти энзимы являются кислыми белками с изоэлектрическими точками в пределах от
1, 3—2,0 до 6,4 и каждый тип, судя по числу пиков кривой элюции, содержит от четырех (у 1-3-р-глюканазы) до семи (у 1-4-(}-глюка — назы) фракций изозимов.
Изучались также экзоцеллюлазы дереворазрушающего бази — диомицета Irpex lacteus (Kanda et al., 1978). Проводилось также специальное исследование у 31 вида грибов-дереворазрушителей активности Срфермента, которое показало, что он обнаруживается только у 7 из них, в основном являющихся возбудителями бурой гнили. К их числу принадлежали Coniophora areda, С. olivacea, С. puteana, Hygrophoropsis aurantiaca, Paxillus panuoides, Serpula himantoides и S. pinastri (Nilsson, 1974).
Наиболее энергичными разрушителями целлюлозы естественно являются дереворазрушающие грибы-базидиомицеты, которые и оказались наилучшим образом изученными в отношении их цел — люлаз (см., например, Lyr, 1959b, 1960; Musilek, 1981; Nilsson, 1974). Комплексы обнаруживаемых у этих грибов целлюлитиче — ских ферментов были различны в зависимости от вида гриба. Так, у Polyporus annosus и Flammulina (Collybia) velutipes (Norkrans, 1957; Lyr, Ziegler, 1959) была найдена как термостабильная цел — люлаза, так и термолабильная fS-глюкозидаза с различной активностью у разных штаммов Flammulina, тогда как у Hydnum hen — ningsii и Polyporus schweinitzii оказалась только (i-глюкозидаза, дающая в качестве продукта гидролиза одну глюкозу. Напротив, у Polyporus betulinus по понижению вязкости карбоксиметилцел — люлозы была обнаружена только «вискозиметрическая» целлюла — за (Bell, Burnett, 1966). Помимо указанных здесь видов дереворазрушающих грибов целлюлаза была обнаружена у рода Irpex, у которого она стимулируется марганцем, у Phellinus igniarius (Стайченко, Федоров, 1969), у Polyporus abietinus, Tricholoma, Porta vaillantii и y видов Corticium.
Среди почвенных дейтеромицетов также встречается большое количество продуцентов целлюлаз, в чем можно убедиться, выращивая их при посеве почвенной суспензии или комочков почвы на фильтровальную бумагу (Verona, Lipidi, 1966) или на среду с добавкой в качестве источника углерода целлюлозного порошка.
К числу целлюлозоразрушающих форм почвенного происхождения принадлежат различные виды Aspergillus, Cephalosporium, Chae — tomium, Humicola, Malbranchia, Sporotrichum, Thermoascus и другие. Много целлюлозоразрушителей оказывается среди термофильных видов. К числу разрушителей целлюлозы относятся также разрушители бумаги Eidamelia deflexa, Sporotrichum bombycinum, Aspergillus terreus и Pйnicillium purpurogenum (Нюкша, 1969)». а также гриб Archangium violaceum. Однако из числа дейтероми — цетов наиболее активными и наилучше изученными продуцентами, целлюлазы оказались Trichoderma viride, Myrothecium verrucaria (Whitaker, 1954, 1956) и Stachybotrys atra (Jermyn, 1956). У последнего из этих грибов был обнаружен набор из четырех компонентов целлюлазы, тогда как у Myrothecium verrucaria и Aspergillus niger установлены термостабильная целлюлаза и термолабильная Я-глюкозидаза. У Myrothecium Я-глюкозидаза оказывается более эффективной, если длина цепочек разрушаемых ею олигосахаридов возрастает с двух до пяти мономеров глюкозы в их составе.
Целлюлазы, видимо, в большинстве случаев являются адаптивными энзимами, которые не образуются на средах с глюкозой и целлобиозой, а главным образом при росте иа средах с клетчаткой (Lyr, 1959). Это было установлено для Tricholoma, Polyporus — annosus (Norkrans, 1957), Fomes pinicola, Schizophyllum commune* Trametes versicolor (Reese, Levinson, 1952) и целого ряда других грибов-дереворазрушителей. Оптимальное значение pH для активности этих ферментов находится обычно в пределах от 5,0 до 6,0.
К наиболее распространенным у древесных растений полимерам, которые ранее обобщали в категорию гемицеллюлоз, относятся ксиланы, преобладающие у лиственных пород, и маннаны, встречающиеся в большом количестве у хвойных. Расщепляющие их ферменты ксилаиазы и маннаназы встречаются обильно как у дереворазрушающих грибов-трутовиков, так у многих сумчатых грибов, например Chaetomium globosum (Sцrensen, 1957), и дей — теромицетов. Обильны они и у паразитических грибов. Среди последних гемицеллюлазы изучались у Fusarium roseum, Sclerotium rolfsii, у Botrytis cinerea и Aureobasidium pul — lulans (Berndt, Liese, 1971). При этом у Botrytis cinerea и Aureobasidium pullulans была обнаружена манианаза, у Chaetomium globosum ксиланаза, а у Sclerotium rolfsii оба этих энзима с дополнением галактаназы и а-1,6-галактозидазы. S. rolfsii оказался способным расщеплять галактомаинаны, а ряд других грибов — разнообразные пентозаны. По-видимому, большинство энзимов этого типа являются у грибов адаптивными, например, у большей части грибов образование ксиланазы стимулировалось ксиланом (Sцrensen, 1957; Lyr, 1959). Оптимальное значение pH для активности этого фермента лежит, по некоторым данным, в пределах 3,0—3,8, а продуктом гидролиза является ксилобиоза, расщепляющаяся далее до ксилозы (Рипачек, 1967).
Поскольку маннаны более широко представлены у хвойных, анализировали наличие соответствующих ферментов у паразитов этих пород деревьев. Ферменты, расщепляющие а-Э-маннозидные связи, были найдены у паразита ели трутовика РЬеШпиэ аЫеНв (гоисИоуа е! а1., 1977а, б). У Р. иЫекв были обнаружены два типа подобных экстрацеллюлярных энзимов — типа экзоманнана — зы, отщепляющей конечную группу маннозы, и эндоманнаназы, расщепляющей маннан на его олигомеры, а также ос-маннозидазу.
Пектолитические энзимы широко распространены как у дереворазрушающих, так и у почвенных и особенно у фитопато — генных грибов, у которых изучалась пектолитическая способность •более чем для восемнадцати видов в связи с предполагаемой ролью этих энзимов в патогенезе или в проникновении в растения ■через их корни.
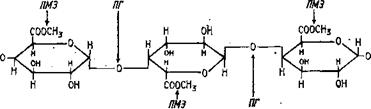
Среди пектолитических энзимов, которые, как и другие гидро- лазы, часто являются комплексом ферментов, различают четыре вида: 1) протопектиназа, или пектинлиаза, освобождающая пектин из его лабильного соединения с клетчаткой; именно этот энзим считается основным виновником мацерации тканей растений, я испытывают его обычно по этому симптому при посеве гриба — продуцента на ломтики картофеля; 2) полигалактуроназа, или лектиназа (ПГ), определяемая чаще всего по понижению вязкости раствора пектина илн пектата кальция, производящая разрыв полимерной молекулы полигалактуроновой кислоты, составляющей пектин, по ос-1,4-уронидным связям на более низкомолекулярные фрагменты или мономеры галактуроновой кислоты (рис. 6.11);
|
Рис. 6.1il. Действие иа пектин полигалактуроназы (ПГ) и пектииметилэстераэы (ПМЭ) (Банфилд, 1963) |
3) пектинметилэстераза, или пектаза (ПМЭ), определяемая по титрованию освобождающихся кислых групп полигалактуроновой кислоты или спектрофотометрически; она представляет собой эсте — разу, расщепляющую эфирную связь полигалактуроновой кислоты с метиловым спиртом (см. рис. 6.11). У видов, способных расщеплять высоко метоксилированные пектины, она встречается обычно в паре с полигалактуроназой (ПГ), так как последняя неспособна расщеплять такие пектины без их предварительного деметоксили — рования; 4) обнаруженная позднее всех других пектолитических энзимов пектинтрансэлиминаза (ПТЭ), расщепляющая уронидные- связи пектина без его предварительного деметоксилирования.
Этот энзим сильно отличается от двух предыдущих, имеющих оптимум действия в кислой среде (при pH 4,0—5,0), тем, что его максимальная активность проявляется в щелочном диапазоне между ^рН 7,5 и 8,5 (Ayers, Papavizas, Diem, 1966; Васильева, Метлиц — кий, 1968; Васильева и др., 1968). Если исходить из этого обстоятельства, то отличающиеся по оптимальным значениям pH пектиновые энзимы Botryiis cinerea (оптимум pH 4,0—5,0) и Pythium debarianum (оптимум pH 8,0—9,0) должны быть: первый — поли^ галактуроназой, а второй — пектинтрансэлиминазой соответственно (Ashour, 1954). Пектолитический энзим Aureobasidium pullu — lans также оказывается по этому признаку пектинтрансэлиминазой (Berndt, Liese, 1971).
Полигалактуроназа, встречающаяся у Neurospora crassa, по ее — описанию несколько отличается от обычной по оптимальному для ее действия pH и термолабильностью. Она разрушается при 70 °С и дает в качестве продуктов гидролиза довольно высокомолекулярные полиурониды с молекулярной массой около 1300. Одиако последний признак не особенно характерен, поскольку и обычная ПГ дает первоначально высокомолекулярные продукты гидролиза, постепенно распадающиеся при длительных экспозициях на мономеры. В последнее время пектинметилэстеразу и полигалактуро — назу рассматривают как единый ферментный комплекс, называемый полиметилгалактуроназой, различая лртшь его экзоформу, от^ щепляющую ко’нцевую молекулу галактуроновой кислоты,, и эндоформу этого энзима, расщепляющую пектин иа его олигомеры (Михайлова и др., 1982).
Относительно степени адаптивности пектолитических энзимов — единодушного мнения пока нет и они в этом отношении еще недостаточно изучены. Полигалактуроназа рассматривалась первоначально как конститутивный энзим (Gвumann, 1949), что, видимо,, подтверждается и для Pйnicillium chrysogenum, хотя пектинметил — эстераза у него адаптивна. Однако у дереворазрушающих грибов ПГ адаптивна и резко стимулируется на средах с пектином (Lyr, 1959, 1960). Точно так же оказываются адаптивными энзимы этого типа у Aspergiltus niger (Фениксова, Молдабаева, 1967). По поводу ПГ Botrytis cinerea возникают значительные разногласия. Одни считают ее у всех видов Botrytis конститутивным (Талиева, Плотникова, 1962), другие находят, что ее образование стимулируется пектином, т. е., что она адаптивна (Ashour, 1954). У этого гриба, а также у Sclerotinia sclerotiorum декстроза даже на среде с пектином угнетала образование ПГ. Тоже касается ПГ Rhizoc — tonia solani, которая в одних работах фигурирует как конститутивная, в других — как адаптивная (Ayers, Papavizas, Diem, 1966), как и соответствующий фермент гриба Aphanomyces euteiches.
Пектинтрасэлиминаза (ПТЭ) у Rhizoctonia solani оказалась адаптивной, а у Pythium debarianum конститутивной. Единствен
ный пектолитический энзим, найденный у Phytophthora infestans,— пектинметилэстераза оказалась конститутивной (Clarke, 1966).
Одновременное наличие у продуцента эндо- и экзоформ ПГ можно установить по непропорциональности между понижением вязкости и увеличением количества редуцирующих концевых остатков мономеров, что особенно выявляется в случае наличия одной эндоформы энзима. У грибов встречаются и те и другие формы фермента, в частности у дрожжей. У дереворазрушающих грибов — трутовиков установлена экзо-ПГ (Lyr, 1959; 1963),. у Neurospora — эндо-ПГ, так же как и у Aphanomyces euteiches. При исследовании ПГ в конидиях Colletotrichum orbiculare как эндо-, так и экзоформа ПГ показали более высокую активность в их матриксе, чем в нативном материале, что говорит о поверхностной локализации их в клетках.
Пектинолитические энзимы грибов встречаются в самых разнообразных сочетаниях, хотя наиболее часто обнаруживается у них полигалактуроназа, найденная в спорах ржавчины Puccinia. glumarum, Р. triticina и Р. suaveolens (Талиева, Плотникова, 1962), у дрожжей, Botrytis cinerea, Penicillium chrysogenum, Neurospora crassa и Aphanomyces euteiches. В сочетании с протопектиназой она была обнаружена в спорах Aspergillus niger и у трех видов Botrytis — В. cinerea, В. anthophila и В. allii, а также у Sclerotinia sclerotiorum и в сочетании с пектинметилэстеразой у Ceratocystis fimbriata и Verticillium dahliae, а с обоими этими ферментами (протопектиназой и ПМЭ) у Fusarium oxysporum f. vasinfectum (Васильева, Метлицкий, 1968). Без сопровождения другими пек — толитическими компонентами протопектиназа была также найдена у Colletotrichum trifolii, пектинметилэстераза у Phytophthora infestans (Clarke, 1966) и Sclerotinia sclerotiorum, а пектинтранс — элиминаза у Rhizoctonia solani (Ayers et al., 1966) и Pythium de — barianum.
Как можно видеть из этого перечня, пектолитические энзимы особенно обильны у паразитных грибов, поражающих корни растений или проникающих в них через корни. В этом отношении особое внимание привлекают два фермента: протопектиназа и
пектинтрансэлиминаза. По материалам Талиевой и Плотниковой (1962), протопектиназа из трех видов рода Botrytis оказалась наиболее выраженной у форм с большей адаптацией к паразитизму (В. anthophila и особенно В. allii) по сравнению с сапротрофным В. cinerea, что авторы связывают с транспортной, т. е. способствующей проникновению в растение функцией этого фермента. Вторым ферментом транспортного назначения, вероятно, окажется, специально для обитателей аридных (пустынных) щелочных почв, пектинтрансэлиминаза с ее оптимумом эффекта при pH около 8,0, очень близким к pH почвенного раствора этой зоны. Ферменты типа ПГ и ПМЭ с оптимумом действия при pH, близким к кислотности клеточного сока растений (от 4,0 до 5,0), вероятно, несут скорее «трофическую функцию» (по терминологии Талиевой) и шире всего представлены у почвенных сапротрофов и грибов де — реворазрушителей, что вполне соответствует занимаемой ими экологической нише.
Пектолитические ферменты грибов получают все большее практическое значение и широко изучаются в этом плане (Банфилд, 1963). Известно, например, что мощный пектолитический комплекс возбудителя так называемой «благородной гнили винограда», В. cinerea, успешно использовался для осветления дессертных вин яри их созревании. Для стабилизации вин и при приготовлении ■фруктово-ягодных вин и соков пектолитические ферменты стали применять и в Советском Союзе, например, при изготовлении вин яз крыжовника или черной смородины (Датунашвили и др., 1976; Кишковский и др., 1974), однако значение их для промышленности этим не исчерпывается. Они оказались очень полезными при обработке различных растительных продуктов, например при экстракции крахмала, витаминов, лекарственных веществ, при осаха- ривании сельскохозяйственных отходов или при заготовке кормов в животноводстве, в связи с чем в последнее время очень повысился интерес к изучению именно этого класса ферментов.
В поисках полезных для различных целей продуцентов пекто — литических ферментов были обследованы разнообразные роды грибов, например 340 штаммов у 38 видов рода Pйnicillium и 132 штамма у 13 видов Fusarium (Айзенберг, Билай, 1970; Девдари — ани и др., 1982), Trichoderma koningii (Fanelli et al., 1978) и ряд <5азидиомицетов, например трутовики Fomitopsis cytisina и Irpex lacteus (Kawai et al., 1978). В ряде из этих работ выяснилось, что наибольший эффект в отношении мацерации растительных тканей дает, как и в случае целлюлаз, применение комплекса ферментов. Так, например, совместное применение полиметилгалактуроназ (ПМГ) и пектинтрансэлиминазы (ПТЭ) из Pйnicillium digitatum для мацерании тканей листа и клубня картофеля можно объяснить их различной активностью в отношении пектинов разного происхождения. Эндо-ПМГ P. digitatum лучше всего гидролизовала свекловичный и лимонный пектины, экзо-ПМГ — свекловичный и лектовую кислоту, а ПТЭ — яблочный и не действовала на пекто — вую кислоту. Вероятно, при этом играло роль не только сродство ферментов к разным пектинам, но и различия в оптимальных для их действия pH, которые имеют значения для экзо-ПМГ — 4,5, для эндо-ПМГ — 5,0, а для ПТЭ — 9,0 (Михайлова и др., 1982). Пектолитические ферменты P. digitatum угнетаются ионами тяжелых металлов, как Fe2+, Ag+, Pb2+, Zn2+, Cu2+, и натрия, a также редуцирующими, поверхностно-активными и хелатообразующими веществами. Эндо-ПМГ несколько активируются ионами Са2+, а экзо- ПМГ — Mg2+ и А12+.
Изучались также пектолитические ферменты, образуемые неуказанными авторами видами родов Pйnicillium и Fusarium, которые наилучшим образом очищались при помощи осаждения их ацетоном из сконцентрированной культуральной жидкости после роста грибов на среде со свекольным жомом (Давдариани и др.,
1982) . Полученный пектолитический комплекс содержал три пек — толитических фермента в препарате из Penicillium и четыре в препарате из Fusarium с оптимальными pH 4,5 и температурой 40°С для активности препарата из Fusarium и pH 5,0 и температурой 50 °С для активности препарата из Penicillium. В полученном препарате из Fusarium преобладали экзо-ПГ и эндо-ПГ, в препарате из пеницилла — пектинметилэстераза. ПТЭ была обнаружена только у Fusarium, и, кроме того, в обоих препаратах имелась большая примесь кислой протеазы и незначительная целлюлаз.
С позиций определения роли пектолитического комплекса энзимов в фитопатологии изучались также ферменты возбудителя вилта хлопчатника, Verticillium dahliae, у которого были обнаружены ПГ, накапливающиеся при низком pH среды (5,5), и ПТЭ, синтезирующаяся при более высоком (pH 7,0—7,5). Оптимум роста и формирования ПТЭ был обнаружен при температуре 28— 30°С. Влияние на заболевание вилтом метеорологических факторов авторы связывают с тормозящим влиянием температуры выше 30 °С на образование патогеном ПТЭ (Согдиева, Васильева, 1975).
Поскольку мацерация растительных продуктов зависит не только от пектолитического комплекса, а часто от дополняющих их целлюлаз и протеаз, комплексные смеси, подобные получаемым Девдариани с сотр. (1982), оказываются более действенными, чем индивидуальные энзимы. Однако возможен и другой подход к этой практической проблеме. Помимо использования естественно синтезирующихся продуцентов смесей гидролитических энзимов применяются также препараты, составленные путем смешивания полученных от разных продуцентов или путем последовательного экспонирования мацерируемого материала в ряде таких энзимов. Одна из таких процедур была разработана при мацерации листьев растений путем чередования обработки сначала пектофоетидином ТОХ и затем целлюлазой из термотолерантного штамма Aspergillus terreus (Логинова и др., 1980). Удобный для такой мацерации комплекс энзимов, содержащий целлюлитические, пектолитические энзимы, глюканазы и ксиланазы, был обнаружен у Fomitopsis су — iisina и Irpex lacteus (Kawai et al., 1978; Noguchi et al., 1978), причем последний трутовик продуцировал также значительное количество протеиназы, что делало его пригодным и для целей пищевого производства (Suga et al., 1978). Ранее, для целей переработки кормов для сельскохозяйственных животных, исследовался также состав энзимного комплекса, образуемого трутовиком Тга — metes sanguinea, который оказался продуцентом протеазы, целлю — лазы, глюканазы и пектиназы при росте в погруженной культуре.
Исследование семи энзимов (протеазы, целлюлазы, гемицеллю — лазы, амилазы, лакказы, каталазы и пероксидазы) плодовых тел 334 базидиальных и сумчатых макромицетов и их изозимов при анализе с помощью электрофореза в геле оказалось полезным для целей хемотаксономии (Lamaison, 1976).
Хитиназа несколько отличается от других карбогидраз тем, что она гидролизует азотсодержащее соединение — хитин. Однако •ее целесообразно рассматривать вместе с ними, так как хитин по своей структуре идентичен полисахаридам и отличается от них. лишь тем, что составляющие его мономеры представляют собой ацетильные производные глюкозамина. Хитиназа гидролизует хитин до ацетилглюкозамина и широко распространена у грибов. Ее можно обнаружить в плодовых телах базидиомицетов, как Coprinus comatus, Phallus impudicus, Fistulina hepatica, и особенно у видов дождевиков Bovista и Lycoperdon. Этот энзим относительно термостабилен и активируется белком сыворотки крови. Появились — также сообщения о другом ферменте, свойственном мицелиальным грибам (например, Mucor rouxii), способном деацитилировать хитин с образованием хитозана.
Хитиназа является одним из основных компонентов комплекса, составляющего улиточный фермент, используемый в экспериментальной микологии для получения сферопластов грибов, лишенных клеточной оболочки. Из 35 видов грибов, исследованных в отношении образования подобного комплекса ферментов, были отобраны Coprinus macrorhizus f. microsporus, С. radians, С. micaceus, Dae — daliopsis styracina и Irpex lacteus (Kawai, 1970). Наиболее активные продуценты этого комплекса, содержащего глюканазы, манна — назы, хитиназу, целлюлазы и протеазу, — Coprinus macrorhizus f. microsporus и С. radians — были способны гидролизовать протеины, глюканы, маннаны и хитин.
Активно гидролизующий хитин дождевик — Lycoperdon perla — tum — образует энзимный комплекс, растворяющий оболочки; дрожжей (Musilkova et al., 1975а, б). Препарат этого комплекса как из природных плодовых тел, так и иэ энзимного концентрата, полученного при росте мицелия в погруженной культуре, полностью — заменяет энзиматически активный препарат из улитки Helix ро — matia.
Ферменты, участвующие в синтезе олиго — и полисахаридов, относятся к синтетазам и включают обычно в качестве кофакторов уридиловые, реже гуаниловые нуклеотиды. При исследовании, хлорнокислых экстрактов из мицелия грибов в них обычно обнаруживается при хроматографическом разделении большое количество таких нуклеотидов, как уридиндифосфатглюкоза (УДФГ) и уридиндифосфатацетилглюкозамин (УДФАГ), — переносчиков мономеров глюкозы и ацетилглюкозамина (Крицкий, 1965; Мансурова, 1966).
Синтетаза специфичного для грибов дисахарида трегалозы или микозы с рациональным названием УДФ-глюкозо-О-глюкозо-6- фосфат-1-глюкозилтрансферазы была обнаружена у гриба-слизе — вика Dict’yostelium discoideum. Количество этого фермента особенно нарастало у Dictyostelium к моменту образования у него плодовых тел (Roth, Sussman, 1966).
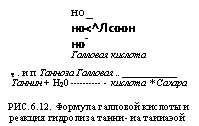
Дубильные вещества, в том числе и таннин, представляют собой глюкозиды кислот, являющихся производными полифенолов, в особенности галловой кислоты, содержащей три гидроксильные — группы и карбоксил в параположении к средней из них (рис. 6.12).. При гидролизе ферментом танназой таннин присоединяет воду ж
расщепляется на галловую кислоту и сахара (Фостер, 1950). Т а н — н а з а была открыта Ролленом еще в 1860 г., а продуцент ее Aspergillus niger, обнаруженный прн брожении галловых орешков, был описан Ван Тигемом в 1867 г. Танназу образуют многие грибы, особенно связанные тем или нным образом с богатыми дубильными веществами широколиственными породами деревьев. Но наиболее активен среди ее продуцентов A. niger. Это адаптивный энзим, образующийся в присутствии в среде таннина или галловой кислоты. Однако дополнительная добавка в среду до 10% сахара не только не снижает активности этого фермента, но и направляет деятельность гриба исключительно на гидролиз таннина, предохраняя от дальнейшего потребления им образующуюся галловую кислоту (Фостер, 1950).
|
но_ но<^Лсоон но — Галловая кислота т. и п Танноза Галловая..___________ Таннин + Н20———— кислота * Сахара Рис. 6.12. Формула галловой кислоты и реакция гидролиза танни — иа таииаэой |
 Ферменты, расщепляющие таннин и фенолы, часто встречаются у грибов, паразитирующих на древесных растениях. К их числу относится паразит, встречающийся на коре деревьев, Endothia parasitica, поражающий их корни Trametes radiciperda (Fomitopsis annosa), и паразит, обитающий на хвое, Herpotrichia nigra. Изученная достаточно подробно Endothia parasitica продуцирует два энзима: 1) эстеразу, расщепляющую эфиры галловой кислоты и танннны, 2) пирогалл азу, фермент типа оксидаз, разрушающий галловую кислоту и гидрохинон. Ингибиторами этих ферментов оказались 10%-й раствор глюкозы и гидрохинон. Наличие у паразитных грибов ферментов этого типа приводит к тому, что мно — тие растения, богатые токсическими для грнбов дубильными веществами, оказываются неустойчивыми к таким патогенам.
Ферменты, расщепляющие таннин и фенолы, часто встречаются у грибов, паразитирующих на древесных растениях. К их числу относится паразит, встречающийся на коре деревьев, Endothia parasitica, поражающий их корни Trametes radiciperda (Fomitopsis annosa), и паразит, обитающий на хвое, Herpotrichia nigra. Изученная достаточно подробно Endothia parasitica продуцирует два энзима: 1) эстеразу, расщепляющую эфиры галловой кислоты и танннны, 2) пирогалл азу, фермент типа оксидаз, разрушающий галловую кислоту и гидрохинон. Ингибиторами этих ферментов оказались 10%-й раствор глюкозы и гидрохинон. Наличие у паразитных грибов ферментов этого типа приводит к тому, что мно — тие растения, богатые токсическими для грнбов дубильными веществами, оказываются неустойчивыми к таким патогенам.
Эстер аз а, сходно с танназой расщепляющая глюкозиды, была обнаружена у гриба Coniothyrium diplodiella и получила название нарингиназы, исходя из ее способности расщеплять нарингин, глюкозид, содержащийся в оболочках плодов цитрусовых и обусловливающий горький вкус сока грейпфрута. Этот фермент, который мог бы найти применение для улучшения вкуса соков цитрусовых, оптимально активен при pH 4,2 и при 60—65° С. При 70 °С он инактивируется в течение 30 мин, но относительно стабилен при обычных температурах в пределах pH от 4,0 до 6,0. Как и действие танназы паразитных грибов, его активность ингибируется в присутствии в среде сахаров.
Протеолитические и фибринолитические ферменты. К числу тидролаз относятся также протеолитические ферменты грибов, которыми они снабжены весьма обильно (Андеркофлер, 1963а), так как они способны широко использовать для питания разнообразные белки и пептиды. Гидролизующие белки энзимы относят к категории протеиназ, гидролизующие пептиды — к категории пеп
тидаз. Отличие пептидаз от протеиназ состоит в их способности отщеплять только концевые остатки аминокислот, в результате чего продуктами гидролиза оказываются только аминокислоты, №> не пептиды, как в случае протеиназ. Различаются эти ферментьь также и по оптимальным для их действия уровням pH: различают — ферменты типа пепсинов, активные в кислых диапазонах pH, и типа трипсинов, связанные с более щелочными условиями среды. В наличии протеолитических ферментов у грибов можно убедиться, при анализе результатов их изучения в мицелии Pйnicillium chry — sogenum, получаемом при ферментации пенициллина (Маттисон,, 1956)", и Aspergillus oryzae, выращиваемом с целью получения комплекса амилолитических и протеолитических ферментов для применения их в пищевой промышленности (Авиженис, Савицкай — те, 1969). Более подробный анализ показал, что в этот комплекс входят следующие энзимы: 1) протеиназы с оптимальной активностью при pH 5,0—6,5, расщепляющие альбумин и казеин; 2) пептидаза типа триптаз, отщепляющая концевые аминокислоты при pH 7,0—7,5; 3) пептидаза, проявляющая активность при pH 8,0— 8,4. Две последние расщепляют желатину и пептон (Маттисон, 1956). Все эти ферменты способны пептонизировать коллаген кожи.
В препарате из мицелия Aspergillus oryzae, оризине ПК, с помощью разделения на сефадексе G-100 были обнаружены три. фракции протеаз, а при разделении на сефадексе А-50 — пять фракций (Авиженис, Савицкайте, 1969), которые различались пс их действию на казеин, гемоглобин и синтетические субстраты. Судя по данным дискового электрофореза, они были составлены различными белками. Среди них были обнаружены два энзима с оптимальной активностью в кислом (pH 4,5 и 5,0) и два — в щелочном диапазоне (pH 7,0 и 10,0), и они различно реагировали на соли Са2+, Mn2+, Cu2+, Ni2+, Со2+, Zn2+, Hg2+, Cd2+. Кислые про — теазы теряли активность в присутствии детергента, ЭДТА и цис — теина. Другие разнообразные грибы при их изучении также обнаруживали протеолитическую активность, например корневая губка Fomitopsis annosus.
К протеолитическим ферментам близки по свойствам керати — нолитические, объединяемые под названием кератиназы, способные гидролизовать кератин шерсти, рога, волос и перьев. Отличие их от протеолитических энзимов состоит в том, что они, вероятно, способны энергично воздействовать на дисульфидные спайки, особенно многочисленные в кератине.
Кератинофильные грибы довольно часто выделяются из некоторых почв (Шатин, 1964), и среди них встречаются как типичные дерматофиты, например Microsporium gipseum и М. cookei, так и сапротрофы вроде Karatinomyces ajelloi. Сюда же, видимо, относятся встречающиеся нередко в почвах горных пастбищ Средней Азии виды Sporotrichum. Кератинолитической способностью обладают патогенные для человека и животных дерматофиты, а также — обнаруживающийся на шерстепрядильных фабриках в обстановке — высокой влажности Myrothecium verrucaria, являющийся разрушителем шерсти в условиях производства. Механизм действия и свойства ферментов этой категории пока, видимо, недостаточно изучены.
Одну из важнейших категорий протеолитической группы энзимов в связи с их медицинским значением представляют собой фи — бринолитические энзимы. Фибринолитические ферменты грибов, еще в 60-х годах привлекли внимание исследователей ввиду возможности их применения для консервативного лечения тромбоэмболических и других заболеваний, связанных со свертыванием крови. По своей природе и тнпу действия эти ферменты близки к трипсину и к другим ферментам типа протеиназ, но многие из них, обладая слабой казеинолитической способностью, высокоактивны в отношении гидролиза фибрина, а некоторые одновременно стимулируют активность фибринолитических систем крови. К последним относятся стрептокиназа, получаемая из Streptococcus haemo — lyticum, и трихолизин — из гриба Trichothecium roseum, тогда как обладающие фибринолитическим действием, но неизвестные как активаторы фибринолиза в организме животного энзима выделялись преимущественно из видов рода Aspergillus.
Идея использования ферментов грибов для ликвидации тромбов и эмболий, по-видимому, принадлежит Стефанини, получившему первый инъекционный препарат этого типа «Аспергиллин О» из Aspergillus oryzae, представляющий собой нейтральный белок, осаждающийся солями тяжелых металлов (Cu2+, Zn2+, Cd2+). Сходный препарат из штамма того же вида гриба был получен в Советском Союзе (Кудряшов и др., 1963; Егоров, Ландау, 1965). Термолабильный препарат из A. orysae, названный аспергиллином (Струкова, 1965), отличался от выделенной из него несколько ранее аспергиллопептидазы В по оптимальному значению pH, типу действия, молекулярной массе и аминокислотному составу. Еще сильнее отличалась от них аспергиллопептидаза А, выделенная из Aspergillus saitoi, оптимально действующая в сильнокислой зоне (pH 2,5—3,0) и способная активировать трипсиноген и химотрип — синоген. Ее субстратная специфичность была шире трипсина, и она представляла собой одноцепочечную структуру с С-концевой группой серина и С-концевой группой аланина с дисульфндной связью. Кроме названных из числа фибринолитических ферментов видов рода Aspergillus, относительно хорошо изученных, необходимо отметить террилитин из A. terricola (Имшенецкий и др., 1965; Имшенецкий, Броцкая, 1967; Самсонов и др., 1972) и браназу из A. ochraceus. Оба этих фермента очень сходны по молекулярной массе и аминокислотному составу и характеру их действия на фибрин и другие белки, но отличаются по оптимальному для их активности pH и их изоэлектрической точке. Из выявленных спектрофотометрически по пикам поглощения двух компонентов террилитина (Коршунов, 1965, 1969) основной компонент (с оптимальной активностью при pH 8,0—10,0) представляет собой нейтральную протеазу, активируемую солями Си2+ и
Zn2+ в концентрации I0-2, с небольшой примесью кислой (оптимальный pH 5,0) (Самсонов и др., 1972). Браназа, очищенная с помощью хроматографии на DEAE-сефадексе (Tцpfer, Pischer, 1974), имеет оптимальный уровень pH 7,8—8,0, активируется и стабилизируется ионом Са2+ (Roschbau, Ives, 1974).
Близкий к этим ферментам по молекулярной массе трихолизин из Trichothecium roseum сильно отличается от них по аминокислотному составу и типу действия, сходному с действием стрепто — киназы. Помимо фибринолитической способности он активирует in vitro и in vivo плазминоген кровн (Андреенко и др., 1968; Andreenko et al., 1974). Трихолизин представляет собой сложный комплекс, содержащий свыше пяти активных компонентов. Контроль с помощью электрофореза в полиакриламидном геле выявил после разделения изоэлектрофокусированием только одну индивидуальную нейтральную фракцию IV с оптимальным для активности pH в пределах между 8,5 и 9,0, которая была изучена наиболее подробно, почти лишенную казеннолитической активности, но с высоким фибринолитическим и активирующим плазминоген эффектом. Все остальные фракции с ИЭТ от 3,7 до 10,0 также были способны к фибринолизу, хотя и с большей примесью казеинолити — ческого действия, и содержали по 2—3 компонента, но оптимальное pH лежало для всех в одном диапазоне от 8,0 до 9,0 (Степанова, 1977).
Довольно глубоко изученным оказался также протеолитический и фибринолитический фермент из Torula ‘thermophila с оптимальным для его активности pH в нейтральной и щелочной зоне и концевой группой глицина (Караваева, Мухитдинова, 1976; Мухитдинова, Караваева, 1976). Фибринолитическая и протеолитическая активность была также найдена у ферментов двух видов рода Pйnicillium пептидазы А из Р. anthinellum с молекулярной массой 32 000 и оптимальной активностью при pH 3,0—4,0 (Hoffman, Sham, 1964; Shaw, 1964) н термолабильной протеазы из P. lilacinum с фибринолитическим эффектом в широком диапазоне pH от 4,0 до
11, 0, являющейся комплексом металлоэнзимов с различной молекулярной массой (Андреева и др., 1972, 1973; Егоров н др., 1972).
Способность активно продуцировать протеолитические ферменты у грибов очень развита, что можно видеть из исследований (Егоров и др., 1971; Прудлов и др., 1972), в которых была обнаружена эта активность у 48 штаммов из полученных 59 (около 81%), относящихся к родам Cladosporium, Fusarium н Alterneria. При’ этом протеазы из Fusarium solani, F. graminearum, Alternaria geophila и Alternaria sp. 62 представляли собой комплексы ферментов с фибринолитической и тромболитической активностью в нейтральной и щелочной зонах pH (Егоров и др., 1972).
Из приведенного здесь перечисления можно видеть, что мик- ромицеты являются очень перспективными источниками фибрино — литических ферментов для применения в медицине. Они слабо токсичны и многие из них (трихолизин, террилитин, браназа и аспергиллин) проходят в настоящее время клинические испытания, а «Аспергиллин О» давно уже является промышленным препаратом, применяемым в медицине США.
3. Окислительно-восстановительные ферменты и
дыхательные цепи грибов
Реакции, производимые большинством из окислительно-восстановительных ферментов, являются крайне необходимыми для основного обмена грибов, поскольку они участвуют как в получении необходимой для синтетических процессов! энергии, так и в подготовке исходных субстратов для этих синтезов, например, в форме восстановления нитратов или сульфатов. Вследствие их интимного участия в построении клеток они чаще бывают эндоэнзимами и имеются у всех грибов.
Окислительные энзимы делятся на: 1) дегидрогеназы, действующие по пути, установленному Виландом с отнятием от субстрата водорода, и 2) оксидазы, действующие, согласно теории Варбурга, через присоединение к субстрату кислорода. Однако это различие нельзя считать принципиальным, поскольку существуют дегидрогеназы, связывающие кислород, а роль большинства окси — даз сводится только к переносу электронов путем изменения валентности входящего в их состав металла. Кроме того, большинство из этих ферментов в восстановленном состоянии действуют как редуктазы (оксидоредуктазы).
Дегидрогеназы в большинстве случаев имеют в качестве ко — ферментов или простетических групп никотинамид или флавины в форме НАД, НАДФ, ФМН или ФАД. В случае НАД-дегидроге- наз вторым кофактором большей частью бывает Zn2+, а вторым компонентом органической простетической группы — аденин, как в никотинадениндинуклеотиде. Аденин является также вторым компонентом флавинадениндинуклеотида.
Наилучшим образом изучены дегидрогеназы дрожжей и некоторых плесневых грибов, в особенности Aspergillus niger. Триозо- фосфатдегидрогеназы дрожжей и A. niger обычно содержат в качестве второго кофактора Zn2+, например, представляющая собой однокомпонентный белок глицеральдегид-3-фосфатдегидрогеназа, алкоголь — дегидрогеназа, фосфофруктокиназа и ряд других дегидрогеназ, участвующих в гликолитических путях ЭМП и ГМФ, как альдолаза и 6-фосфоглюконатдегидрогеназа (Bertrand, de Wolf, 1958; Wacker et al., 1958). Необходимость цинка для действия этих энзимов доказывается подавлением активности фермента
1 : 10 фенантролином. При присоединении двух молекул ингибитора к одному атому Zn2+ энзим инактивируется необратимо. В алкогольдегидрогеназе одна молекула ферментного белка комбинируется с четырьмя атомами цинка. Содержащие цинк дегидрогеназы подавляются многими факторами, например, фенантро — лин связывает цинк, Р-хлормеркурбензоат и Ag2+ — активные SH-группы, мочевина — ферментный белок.
Участие в действии таких ферментов в качестве кофакторов НАД и НАДФ было доказано также с помощью гистохимических методов, основанных на образовании формазана из нитросинего тетразолия при инкубации с НАД или НАДФ и с соответствующим субстратом дрожжевых грибов Paracoccidioides brasiliensis и Saccharomyces cerevisiae (Reiss, 1967). В случае Saccharomyces cerevisiae исследовалось этим способом наличие НАДФ-пирид — оксинфосфатдегидрогеназы, трансформирующей пиридоксинфос — фат в пиридоксальфосфат. При этом помимо установления специфичности этой реакции путем подтверждения эффективности действия всех обнаруженных биохимическими методами ингибиторов (хлормеркурбензоат и антагонист пиридоксина 4-деоксипиридок — син-HCl) было отмечено отсутствие связи этого фермента с митохондриями. С помощью введения акцепторов электронов (дихлор — фенолиндофенола или трифенилтетразолиумхлорида, ТТХ) было установлено наличие двух энзимов — НАДН2- дегидрогеназы и ал — когольдегидрогеназы у базидиомицета Oudemansiella mucida, причем дегидрогеназа НАДН2 оказалась промежуточным переносчиком электронов в дыхательной цепи этого гриба. В случае окисления исходных субстратов с гидрофобными свойствами часто роль промежуточного переносчика переходит к НАДФН2-дегидрогеназе, для формирования которой необходимо присутствие фосфорили — рующего НАД-энзима; НАД-киназы. Именно с формирования этого фермента начинается прорастание конидий Neurospora crassa, и максимум его накопления достигается уже через 30 мин от начала их инкубации в воде (Афанасьева и др?, 1982).
В начале интенсивного вегетативного роста гриба, при потреблении углеводов, активность НАД-кииазы сильно падает и снова нарастает при спаде интенсивности роста через сутки инкубации. С помощью электрофореза в полиакриламидном геле было обнаружено, что НАД-киназа у N. crassa присутствует в четырех формах субъединиц с разной молекулярной массой, из которых наиболее высокомолекулярные (I и II) характерны для конидий, а III форма с меньшей в 11,2 раза молекулярной массой преобладает в вегетативном мицелии (Афанасьева и др., 1982).
Дегидрогеназа, содержащая флавины, в частности глюкозоок — сидаза (Я-D-глюкоза: 02-оксидоредуктаза), содержащая ФАД,
была впервые обнаружена Мюллером в отпрессованном соке из Aspergillus niger еще в 1926 г. В дальнейшем она была установлена у A. oryzae, Pйnicillium notatum, P. chrysogenum, дрожжей и ряда других грибов (Андеркофлер, 19636). Этот фермент, окисляющий глюкозо-6-фосфат в 6-фосфоглюконат, наряду с 6-фосфо- глюконатдегидрогеназой был найден также у различных видов Phytophthora (Clare, Zentneyer, 1966). Из других дегидрогеназ в прорастающих спорах Puccinia recondita обнаружена дегидрогеназа яблочной кислоты (Macko, Novacky, 1966), а в спорах гри — бов-трутовиков Trametes versicolor и Phellinus igniarius — флавин — содержащая ксилозооксидаза. К числу флавиновых дегидрогеназ относится также сукцинатдегидрогеиаза. Участие флавиновой си
стемы в дыхательной цепи было также обнаружено у базидиоми — цета Oudemansiella mucida, а флавинсодержащие галактозоокси* даза и глюкозооксидаза у Polystictus circinatus. Флавиновые энзимы О. mucida типа глюкозо-2-оксидазы оказались способными окислять моносахариды в соответствующие им гексозулозы, например 0-арабино-2-гексозулозу (Vole et al., 1978, 1980).
Оксидазы не все способны самоокисляться с присоединением кислорода, как это должно быть исходя из теории Варбурга. Ферменты этого типа скорее можно обобщить, исходя из структуры их простетических групп, которые в подавляющем большинстве случаев представляют собой порфирины со строением гема, составленного из четырех пиррольных фрагментов (рис. 6.13). Азотные компоненты гема способны высвобождать валентности, могущие удерживать в центре этой структуры какой-либо металл. Примером типа такой структуры может служить строение протопорфи — рина IX (рис. 6.14). Наиболее типичны среди них цитохромы, содержащие железо, осуществляющее реакцию переноса электронов типа
—в
Fe2+ ZHHHFe3+.
+“•
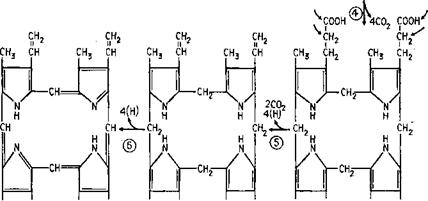
Биосинтез порфиринов (рис. 6.15) исходит из глицина и сукци — нилкоэнзимаА, причем при декарбоксилировании и отнятии воды на первом этапе получается 8-аминолевулиновая кислота. При дальнейшей циклизации получается порфобилиноген, из четырех фрагментов которого формируется уропорфиринШ. Четвертый этап биосинтеза состоит в потере уропорфириномШ четырех молекул СОг с трансформацией его в копропорфириногенШ, который, теряя еще две молекулы СОг и окисляясь, превращается в протопорфириноген1Х. Дальнейшее его окисление с потерей четырех атомов водорода приводит к образованию протопорфирина1Х.
У головневых грибов в синтезе цитохромов, видимо, принимает участие цинк, что видно на примере Ustilago sphaerogena, резко повышающего продукцию цитохрома в присутствии повышенных доз цинка. То, что цинк участвует при этом в синтезе белкового — компонента энзима, можно видеть из результатов внесения одновременно с цинком специфичного ингибитора И-РНК актиномици — на D, который полностью подавляет синтез цитохрома у Ustilago sphaerogena (Brown et al., 1966). Наиболее подробно цитохромы изучались у дрожжей, однако с помощью спектрофотометрии они также были обнаружены у очень большого ряда гифообразующих грибов из всех классов (Lindenmayer, 1965).
В настоящее время у грибов известно восемь видов оксидаз со строением цитохромов, относящихся к трем из четырех известных типов структур этих ферментов. У них встречаются цитохромы
а, аи аз, Ь, Ь, Ь2, с и сх. Не обнаружен у грибов только встречающийся у бактерий цитохром типа d.
Большая часть этих энзимов участвует в переносе электронов в дыхательной цепи, и только два из них (аі и Ь) образуются в анаэробных условиях. Цитохром 62 отличается от всех других ци — тохромов тем, что он постоянно связан с ДНК, состоящей из 30 нуклеотидов, потеря которой, однако же, не влияет на активность фермента. Функции этого цитохрома состоят в специфическом окислении лактата и других оксикислот.
|
,СН Н3 |
|
tiC< |
|
)с |
|
N N не’ ^СН Ч_/ X / І II нс*ч /Ч /с ^сн сн сн сн |
|
|
|
|
 |
|
|
|
|
|
|
У грибов известен также не вошедший в сводку Линденмейера цитохром Р-450, окисляющий алканы и другие липиды через мо- нооксигеназную микросомальную систему, содержащую кроме цитохрома Р-450 еще НАДФНг, цитохром P-450-редуктазу и фос — фолипидный компонент (Мауэрсбергер, Матяшова, 1980). Она формируется при росте на я-алканах как единственном источнике углерода и энергии у Candida tropicalis, C. guillermondii, Torulop — sis candida, участвуя в окислении алканов и жирных кислот. При достижении стадии торможения роста дрожжей концентрация цитохрома Р-450 в их клетках значительно снижается. Этот фермент является адаптивным, специфически формирующимся при росте дрожжей на средах с гексадеканом, пальмитиновой кислотой или при использовании эндогенных липидов после исчерпания источника углерода при росте на среде с глюкозой (Ильченко и др.,
1980) , что было установлено при исследовании культур Candida lipolytica, C. tropicalis, C. utilis, C. guillermondii и Torulopsis Candida Оксигеиазиая система, включающая цитохром Р-450 и
|
соон соон соон сн, I I I ‘ |
|
соон сн, I I 2 сн, сн, I ‘ I 2 с——- с |
|
/ N Н Порфобилиноген |
|
соон снг Р1* СOSКоА |
|
сн, |
|
Н20, со, |
|
2Нг0 |
|
=0 |
|
СукцинилКоАф NHfCHf СО CHjCDnHj-CHj-C СН (D |
|
ch2nh2 соон Глицин |
|
/ N н2 S-аминолевули — нодая кислота |
|
соон соон £нг |
|
сн, I 1 сн2 |
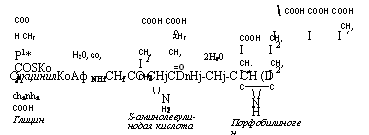 |
|
|
|
|
|
|
|
сн2 |
сн2 сн3 |
сн3 сн2 |
сн2 сн. |
сн3 сн2 |
сн2 сн3 |
|
сн, 1 |
сн2 |
сн, 1 1 |
сн, 1 * |
сн2 |
сн2 |
|
соон |
соон |
соон |
соон |
соон |
соон |
|
Протопорфирин Ж |
|
ПротопорфириногенШ |
|
Копропорфириноген Ш |
Рис. 6.15. Биосинтез порфирииов (Девис и др., 1966)
НАДФН, подавляется оксидом углерода (II), но является цианид — резистентной и нуждается в наличии молекулярного кислорода, предпочтительнее использует алканы со средней длиной цепн, окисляя их сначала в соответствующие алкоголи (и гидроксипро — изводные) и альдегиды, а потом в жирные кислоты (Weete, 1980). Пигмент гемопротеин Р-450 был впервые открыт у Saccharomyces cerevisiae в корпускулярной фракции гомогената его клеток.
Путь окисления алканов при посредстве цитохрома Р-450 показан в табл. 6.8. Субстратспецифичные оксигеиазы грибов, функ-
Таблица 6.8
Схема окисления л-октаиа Candida llpolytlca при участии цитохрома Р-450 (Weete, 1980)
НАДФН+Н+ НАДФ+ НАДФ+ НАДФН+Н+ НАДФ+ НАДФН+Н+
TOC o "1-5" h z I t I t I t
І І І (___________ J_______ І
с7н15—сн,——— с7нисн2он——————- ► с, н16сон——————— м:7н15соон
(1) (2) (3)
октаи 1-октаиол октаиал октаиоевая
кислота
(1) — п-октаигидроксилаза; (2) — 1 — октаиолдегидрогеназа; (3) — октаналдегидроге — наза.
ционирующие с помощью цитохрома Р-450, изучались в течение последнего десятилетия довольно интенсивно как в целях использования грибов для переработки различного типа углеводородов, так и в целях трансформации стероидов при изготовлении лечебных препаратов типа кортизона. Одним нз ранних исследований этой категории было обнаружение у Aspergillus niger железозависимой антранилатгидроксилазы, производящей двойное гидрокси — лирование антраниловой кислоты, но теряющей эту активность при росте гриба на среде с дефицитом железа или в присутствии о-фенантролнна. Фермент реактивировался в присутствии ферри — этилендиаминтетрауксусной кислоты (Ре2+-ЭДТА) илн феррицит — рата (Kumar et al., 1973). Позднее у гриба Acremonium sp. была обнаружена НАДФН-зависимая оксигеназа сходного типа, окисляющая этан сначала до этанола, а потом до ацетальдегида и соответствующей кислоты (Davies et al., 1976). Сходство этой окси — геназы с оксигеназой на основе цитохрома Р-450 состояло в том, что в бесклеточном гомогенате она оказалась связанной с фракцией. микросом. Однако испытание ее СО-спектра поглощения не дало характерных для цитохрома Р-450 результатов.
Способность производить гидроксилирование ароматических углеводородов свойственна мукоровому грибу Cuninghamella bainieri, причем связанный с этим окислением фермент содержит цитохром Р-450. Фермент НАДФН-зависимый, теряет активность в присутствии типичных для Р-450 ингибиторов (СО, SKF-525A и метирапон), имеет оптимальный pH 7,8 и обладает цианидрезис — тентностью. Кроме того, он связан с микросомной фракцией и его принадлежность к оксигеназам на основе цитохрома Р-450 подтвердилась его отношением к металлам (например, подавление активности Fe3+ и стимуляция ее Fe24-/ Ferris et al., 1976).
Гидроксилирование с помощью грибов стероидов и другие их трансформации, например, связанные с формированием двойных •связей в кольце, также производились, причем преимущественно «с применением грибов из числа дейтеромицетов. Способен производить эти трансформации и ряд базидиальных грибов, например, гидроксилирование в положениях 2-0, 7-а, 7-0, 11-а, a также восстановление кетоформ в позициях 20-0 в гидроксильную форму. Производить трансформации 3-0-гидрокси-5-андростен-17-она оказался способным базидиальный гриб-дереворазрушитель Pleurotus ‘Ostreatus (Thoa et al., 1978). Некоторые виды грибов способны производить и обратные реакции, приводящие к восстановлению окисленных форм гидроксисоедннений. Такая реакция, производимая гидроксипируватредуктазой, была обнаружена у Aspergillus Jiiger.
Уже давно было установлено, что цитохромная дыхательная щепь грибов, исключая микросомальные оксигеназы, связанные с цитохромом Р-450, находится в митохондриях. Первоначальные исследования цитохромов грибов проводились спектроскопически на неразрушенном мицелии или на нефракцнонированном его гомо — генате. Из исследованных 45 видов грибов все содержали цито — хромы типов а, b и с и цитохромоксидазу (а3), хотя некоторые из них показывали отличия друг от друга в деталях спектров поглощения.
Позднее исследовалась фракция отмытых при центрифугировании при lOOOOXg митохондрий базидиомицета Schizophyllum commune, как нативных, так и в присутствии различных ингибиторов (Niederpruem, Hachett, 1961). Дыхание митохондрий ингибировалось соответственно 97, 95 и 85%-м фенилмеркурацетатом, анти — .мицином А, блокирующим дыхательную цепь на уровне перехода между цитохромом b и с и блокирующими цитохром аз цианидом и азидом, а также высокими концентрациями (порядка 10_3—10-4) динитрофенола, разобщающего окисление с фосфорилированием. Митохондрии S. commune окисляли НАДН особенно в присутствии цитохрома с, восстанавливающегося при включении в систему цианида. Этими и другими тестами было показано наличие в митохондриях цитохромов Ь, с и а—а3, подтверждаемое не только подавлением системы цианидом, но и реакцией подавления дыхания в темноте оксидом углерода (II). В митохондриях S. commune выявлены также сукцинатцитохром с редуктазная, цитохром с, НАДН — и сукцинатоксидазная и цитохром а оксидазная системы. Расчет на основе спектрофотометрических измерений показал четко эквимолярные концентрации в митохондриях а, Ь и с типов цитохромов.
Исследовался также дифференциальный спектр (при —196 °С) фракции митохондрий Agaricus campestris var. bispora (Gallinet, 1974, 1976), показавший, что в них содержатся цитохромы а—а3
и, по-видимому, не менее трех цитохромов с пиками поглощения при 552, 557 и 562 нм, а также цитохромы с и С. Соотношения цитохромов типов а, b и с были равны 1,0: 1,5: 2,0 соответственно. Сопоставление этих данных с соответственными расчетами для других видов грибов показывает близкие соотношения цитохромов только у Aspergillus niger, тогда как у дрожжей Saccharomyces carlsbergiensis и Neurospora они увеличиваются для цитохромов. b и с более прогрессивно (табл. 6.9).
|
Таблица 6.9 Подсчет концентраций трех типов цитохромов, определяющих их стехиометрию у разных видов грибов (Gallinet, 1974), нмоль/мг белка
|
Исследование кинетики восстановления цитохромов Agaricus campestris показало, что у него присутствуют только два цитохро — ма типа Ь, которые восстанавливаются в присутствии сукцината, с пиками поглощения при 559 и 562 нм, обнаруживаемые при температуре жидкого азота (—196°С).
Цепь переноса водорода (или электронов), т. е. дыхательная цепь в полном ее виде, включает еще и другие компоненты, а именно ферредоксины и коэнзим Q. Ферредоксины или железо — серопротеины мало изучены в отношении их структуры. Известно, что они включаются в митохондриальный перенос электронов в тесном сочетании с флавиновыми энзимами в процессе их контакта с пиридиновыми дегидрогеназами. В их составе имеется различное количество (от двух до семи атомов) негемового железа и такое же количество лабильных сульфгидрильных групп, освобождающихся в виде H2S при подкислении. Подробнее изучены ферредоксины — участвующий в фотосинтезе хлоропластов шпината и в усвоении атмосферного азота, выделенный из анаэробного микроба Clostridium pasterianum (Ленинджер, 1974), но считается, что они есть и у грибов (Lyr et al., 1975).
Коэнзим Q относится к числу хинонов, формирующихся в шунте терпенов (рис. 6.16) и совершенно несходных по структуре с.
щитохромами. К ним относятся обнаруживаемые у грибов убихи — ноны и убихроменолы.
Убихиноны различного строения обнаружены сейчас у значительного числа грибов, как дрожжевых, так и гифообразующих из жлассов сумчатых, базидиальных и несовершенных грибов (1лп-
о
■Шхинон(Щп) снз-0~|Г|ГгСНз 8<п<Ю снгоДу%нгсн=с-сн^н
О СН3
ОН
Убихромшл(иСп) СН^-О-Л^^г-СНз
*Н3-оА^СН^СН^С-СН^СН^СН<-СНфН.
£4 п< 10 СН
‘з
^— 0—/ СН,————————- СН,
о
СН.-Й’^Ч-Н
Пластохинон (Рй3) Сн’ОсНгСН=МН2]-Н
I лз 0 СН3
ОН
Витамин £ СНз-г^^гСНз
{а-токоферол] СН3А^СНГСНгС-СН^СНгСНгСНЧН^-Н
-■2 ‘*,у] -2 1-2 —2 | —
_0_/сн3 сн3
Витамин К, цЗС^СН^С^С-СН^СНз-СН^-СН-СН^-Н
О СН3 СН3
Рис. 6.16. Строение хинонов, участвующих в транспорте электронов в дыхательной цепи
<3епшауег, 1965). Образуются оии как в анаэробных, так и в аэробных условиях, и установлено их место в дыхательной цепи между флавинами в сочетании с ферредоксинами и цитохромом Ь (Ленинджер, 1974).
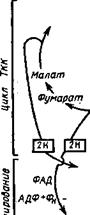
Расположение упоминавшихся выше ферментов в дыхательной цепи и связь ее с метаболитами цикла трикарбоновых кислот приведены на рис. 6.17. Оно слагается из последовательности: НАД-> -►флавопротеид (ФМН)-*-кофермент (убихино’н)-»-цитохром Ь-*- -►цитохром с (или С—с)->-цитохром а-*-кислород воздуха. Конеч — ным продуктом реакции является вода.
Параллельно существует также система, начинающаяся с фла — виновой сукцинатдегидрогеназы (кофермент ФАД), субстрат сук — цинил-КоА, переносящая электроны прямо на убихинон. Сходный
|
Ацетил-КоА |
|
Оксалацетат |
|
НАД ♦ Флавопротеид |
|
Нитрат ч Цисамнитат Изоцитрат |соП*-1Д _____ а-Кетоглутарат [со? " .Сукцинат |

|
кофермент в » * Цитохром Ь______________ АДФ+ФН —————- *-АТФ Цитохром с |
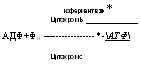
|
Рис. 6.17. Схема дыхательной цепи и окислительного фосфорялирования. Конечные продукты стадий в рамке (Ле — нинджер, 1074) |
|
Цитохром а АДФ+<Рн—*~11——— И |
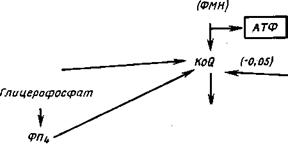
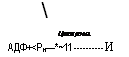 процесс претерпевают продукты распада жиров — глицерофосфат и ацилированные КоА производные жирных кислот (рис. 6.18). Путь переноса электронов через НАД возможен с изоцитрата, малата и пирувата, также с глутамата и различных 3-оксиацилпроиз- водных КоА. На трех этапах дыхательной цепи может происходить сопряжение окисления с фосфорилированием (образованием АТФ), а именно между ФМН и Ко<3, цитохро — мами Ь и с, цитохромом а и кислородом воздуха, где это позволяет высокая разность энергетических потенциалов — перехода коэнзимов (£</)• Альтернативные дыхательные цепи грибов. Истинное место убихинона (коэнзима (^) в дыхательной цепи грибов вскрылось в связи с исследованиями в области механизма действия различных ингибиторов дыхания (рис. 6.19). Обнаруженные ранее альтернативные пути переноса протонов (двух атомов водорода) — первый через НАД->флавин — мононуклеотид (ФМН) и неге — мовое железо (ферредоксин) (I), второй через сукцинат->флавинадениндинуклеотид (ФАД) и другой железосеропротеин (II) — оказались сходящимися. Место их соединения — это этап цепи переноса, занятый коэнзимом (^, с которого осуществляется передача заряда на цитохром.
процесс претерпевают продукты распада жиров — глицерофосфат и ацилированные КоА производные жирных кислот (рис. 6.18). Путь переноса электронов через НАД возможен с изоцитрата, малата и пирувата, также с глутамата и различных 3-оксиацилпроиз- водных КоА. На трех этапах дыхательной цепи может происходить сопряжение окисления с фосфорилированием (образованием АТФ), а именно между ФМН и Ко<3, цитохро — мами Ь и с, цитохромом а и кислородом воздуха, где это позволяет высокая разность энергетических потенциалов — перехода коэнзимов (£</)• Альтернативные дыхательные цепи грибов. Истинное место убихинона (коэнзима (^) в дыхательной цепи грибов вскрылось в связи с исследованиями в области механизма действия различных ингибиторов дыхания (рис. 6.19). Обнаруженные ранее альтернативные пути переноса протонов (двух атомов водорода) — первый через НАД->флавин — мононуклеотид (ФМН) и неге — мовое железо (ферредоксин) (I), второй через сукцинат->флавинадениндинуклеотид (ФАД) и другой железосеропротеин (II) — оказались сходящимися. Место их соединения — это этап цепи переноса, занятый коэнзимом (^, с которого осуществляется передача заряда на цитохром.
Блокирование цианидом, оксидом углерода (II) или азидом этапа цитохрома а + цитохромоксидаза (цитохром аз) приводит к прерыванию перехода от окисленного состояния к восстановленному и обратно всех компонентов цепочки цитохромов, что на модели клеток животных дает в результате полное прекращение дыхания. Однако у целого ряда нечувствительных к цианиду грибов дыхание при этом не прекращается, причем даже тогда, когда блокируется с помощью ротенона, дексона или амитала начальный
этап цепи I через НАД и ФМН. Блокировка антимицином А перехода от цитохрома Ь к цитохрому с может в этом случае привести даже к стимуляции дыхания. Полное прекращение дыхания дости-
|
|
||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|

![]()
Цитохром с (+0,254)
Цитохром а+а3 (*0,28)
*-атф
О (+0,82)
Рнс. 6.18. Места вхождения электронов от различных субстратов в дыхательную цепь и места окислительного фосфорялнрования: ФП — флавопротеины; в скобках уровни Е0′, V (Ленннджер, 1974)
гается только при одновременном с цитохромами блокировании карбоксином, теонилтрифторацетатом (ТТФА) или 8-оксихиноли — ном этапов пути II через сукцинат, ФАД и железосеропротеин. При блоке одних этапов цитохромов дыхание значительно усиливается, не уступая нормальному в контроле (Ьуг е1 а!., 1975). Это
прямо указывает на наличие альтернативного пути дыхания с усвоением кислорода через иные, чем цитохромы, пока еще не изученные акцепторы. Заблокировать этот путь можно только ма-
1У1 Цитохром а/а3 [CNjCO •L ^ J Азид
Цитохром с
|
OI Цитох ш j |
|
Неизученный этап |
 ! Цчтохром с, АнтимицинА
! Цчтохром с, АнтимицинА
1
KOQ
|
|
|
|
|
|
|
|
|
|

|
L <РМН J НАДН |
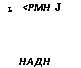
ТТФА- теонил — трисрторацетон
^ФАД/ FeSPj
Малонат
Сукцинат
НЬЧ-железо — серопротеин
Рис. 6.19. Схема главной и альтернативной дыхательной цепи грибов и болоки — рующих различные этапы ингибиторов. Места действия ингибиторов указаны стрелками с волнистой чертой (Ьуг е1 а1., 1975)
лонатом или веществами, воздействующими на ферредоксиновый компонент цепи II, как карбоксин, 8-оксихинолин и ТТФА (см рис. 6.19).
На следующем этапе этого’ альтернативного пути могли бы. возможно, оказаться, например, меланины с их способностью ь аутоокислению и восстановлению, хотя до настоящего времени нх
окисление считается свободным, не связанным с способностью к фосфорилированию. Это в определенной степени поддерживается значительно меньшей потребностью меланинсодержащих форм в кислороде при их дыхании (Жданова, 1976) и цианидрезистент — ностью при чувствительности к блокаде цепи II окисления темно — окрашенных грибов как Trametes versicolor, Ustilago maydis, виды аскомицетов из порядков Helotiales и Sordariales (Lyr et al., 1975). Исключение составляет краснопигментная, но цианидорезистентная Rhodotorula mucilaginosa.
Наличие у грибов альтернативных путей дыхания имеет принципиальное значение для отбора системных веществ, применяемых для борьбы с болезнями растений. Были проведены обширные эксперименты на дрожжевых грибах из родов Torulopsis и Candida,, показавшие, что количество альтернативных путей переноса электронов в дыхательной цепи грибов, видимо, достигает значительного числа вариантов. Только у одного Torulopsis candida, по мнению исследователей, их намечается не меньше четырех (Ильченко, Соколов, 1980). Прежде всего были замечены различия в первых ступенях цепи переноса, заключающиеся в замене блокируемого цианидом обычного пути электронного транспорта цианид — резистентным, формирующимся при росте на нормальных алканах, сопровождаясь продукцией цитохрома Р-450, участвующего в их гидроксилировании до алканоло’в (рис. 6.20). При росте на глюкозе цитохром Р-450 не появлялся до ее полного исчерпания (Ильченко и др., 1980).
Метаболизм п-алканов (а также, видимо, ряда жирных кислот и лнпидов), как выяснилось из опытов с ингибиторами, протекает на базе микросомальной фракции цитоплазмы (Ильченко, Соколов, 1980) при участии НАДФ и цитохром-Р-450-редуктазы. Он ингибируется, сходно с подавлением ингибиторами микросомальной оксигеназы, СКФ-525А, метирапоном и бензогидроксамовой кислотой (БГК). Эта система была обнаружена кроме Torylopsis candida еще у трех видов Candida (C. guillermondii, C. tropicalis и C. lipolytica/Мауерсбергер, Матяшова, 1980), которые все были способны утилизировать для роста л-алканы, и отсутствовала у не растущих на этом субстрате видов.
Помимо этой системы, связанной с цианидрезистентным путем, блокируемым БГК (Ильченко, Соколов, 1989), по-видимому, имеется второй устойчивый к цианиду путь переноса электронов, где конечное окисление осуществляется за счет перекиси водорода при участии цитохром-с-пероксидазы. Схематическое изображение описанных путей переноса электронов у Torulopsis candida приведено на рис. 6.20.
Среди других альтернативных путей дыхания грибов известно наличие цианидрезистентного митохондриального пути окисления у гифообразующих грибов, например у Moniliella tomentosa. У этого гриба такое дыхание возникает под влиянием нормальных пропанола и бутанола, тогда как метанол и этанол не способны его индуцировать. Причина индукции цианидрезистентного дыхания
заключается в способности Сз и С* алкоголей интерферировать с окислительным фосфорилированием, что приводит к снижению роста и накоплению этилового спирта (Уепёег1еус1еп е! а!., 1978).
0:
Цитохром a+oj
|
f |
|
f- tmi і…… I |
|
I § Ч £ |
|
KCN |
|
Цитохром с |
|
Неизбестный акцептор |
|
Цитохром Ь |
|
I § Є |
|
Пероксидаза |
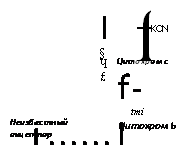 |
|
|
|
 |
|
|
|
|
|
|
Ротенон
|
Цитохром Р — i*S0 |
|
CKCP-S2SA (или метирапон) |
|
НОЛЫ |
|
+0Н‘ |
|
НАДФ I t ъ п — алка- ! з: |
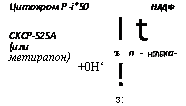 |
|
|
|
|
|
п • алканы (или липиды)
Рис. 6.20. Предположительная схема альтернативных путей переноса электронов у Torulopsis Candida и других дрожжей из рода Candida в зависимости от состава среды и фазы роста: БГК — бензогидроксамовая кислота; АА — аитими — ции А (Ильчеико, Соколов, 1980)
Цианидрезистентность дыхания была также обнаружена у грибов Fusarium sambucinum (Акименко и др., 1981) и Fusidium coccineum (syn. Acremonium fusidioides Gams ДТелеснина и
.др., 1980), изучавшихся в связи с образованием ими антибиотиков знниатина и фузидиевой кислоты. Эксперименты проводились на фоне исследования ингибиторов дыхания. У Fusudium энергообеспечение, способствующее росту биомассы, связано в основном с окислительным фосфорилированием, локализованным в митохондриях, и с дыхательной цепью с включением цитохромов. Введение ингибирующего синтез ферментов этой цепи хлбрамфеникола переводило активного продуцента фузидиевой кислоты полностью на цианидрезистентный путь дыхания, и выход антибиотика на ■единицу биомассы повышался в три раза. Наоборот, при ингибировании цианидрезистентного дыхания салицилгидроксаматом он снижался в 4,5 раза. По этим данным, а также по нарастанию интенсивности циаиидрезистентности от неактивных штаммов к обильно продуцирующим антибиотик (в конце ферментации от 15—16% До 90—100% от полной дыхательной активности) можно было вывести заключение, что синтез данного антибиотика тесно ■связан с ингибируемым гидроксаматами путем свободного окисления, возможно, ароматических веществ, в котором, например, формируются меланины.
В случае биосинтеза антибиотика рода Fusarium, энниатина, сходное исследование привело к несколько иным результатам (Акименко и др., 1981). Интенсивность синтеза энниатина связана «с потреблением пула АТФ, которбе более выражено в период усиленного роста и менее явно в стационарной фазе, в период наиболее активного синтеза антибиотика. Соответственно у активного лродуцента переход в конце ферментации на цианидрезистентное дыхание был менее выражен, чем у неактивного. И то и другое говорит о более, чем в случае фузидиевой кислоты, интенсивной «вязи биосинтеза энниатина с энергетическим обменом и синтезом новых ферментных систем, в частности связанных с затратой энергии гидролиза АТФ.
Авторы указанной работы считают, что цианидрезистентное дыхание, так же как и сверхсинтез метаболитов (например, лимонной кислоты), является вариантом сброса избыточной свободной энергии в случае цианидрезистентного дыхания, протекающего на уровне коэнзима Q в дыхательной цепи. Однако скорее все эке можно считать, что синтез лимонной кислоты (или например, этанола) нельзя причислять только к футильным («бесполезным») циклам, существующим исключительно для сброса лишней энергии, так как эти продукты легко используются в основном обмене. То же касается и близкой по структуре к стеролам и меланинам 4>узидиевой кислоты. Меланины, как и стеролы, помимо других функций используются в обмене, о чем говорит поддержка ими жизнедеятельности и синтезов, их окисление в процессе дыхания И включение В НИХ не ТОЛЬКО кислорода, НО И меченной ИЗОТОП0М углекислоты. Судя по согласованности эффекта гидроксаматов в отношении синтеза меланинов (Жданова, 1976) и цианидрезистентного дыхания (Телеснина и др., 1980; Акименко и др., 1981), их формирование должно идти именно при участии этого энерго
дающего процесса на базе полифенолоксидаз. В пользу последней гипотезы в некоторой степени говорят также исследования группы авторов (Трутко и др., 1980) по влиянию на цианидрезистентное дыхание Candida lipolytica дефицита ряда микроэлементов.
Несмотря на сильное угнетающее влияние дефицита железа на синтез всех цитохромов (включая и цитохром с и его пероксидазу),. цианидрезистентное дыхание не угнетается, а даже стимулируется при его дефиците у данного организма. Правда, ускорение появления цианидрезистентного пути в дыхательном метаболизме С. lipolytica наблюдается также и при дефиците меди, вследствие чего- вопрос о возможной природе цианидрезистентных оксидаз этого — организма остается пока в значительной мере открытым.
Полифенолоксидаза. К числу полифенолоксидаз, важных для некоторых путей окисления и формирования меланинов, ранее относили две категории: собственно полифенолоксидазы, или лакка — зы, окисляющие фенолы, и тирозиназу, окисляющую азотсодержащие соединения с бензольным кольцом, например тирозин или фенилаланин. Сейчас эти ферменты считают за единую группу. Ферменты этого типа, видимо, имеют строение гемов, однако » противоположность цитохромам в их состав входит не железо,, а обычно закисная медь. Поэтому грибы, образующие обильно тирозиназу, нуждаются в повышенных дозах меди и могут иногда добывать ее из медьсодержащих фунгицидов. Железо и марганец могут выступать как конкуренты и ингибиторы лакказы.
Лакказой, окисляющей такие соединения, как перокатехин,. гидрохинон, резорцин, бензидин и т. п. в соответствующие хиноны,. обладает большинство грибов — дереворазрушающих базидиоми — цетов, например Oudemansiella mucida, Polyporus versicolor, Poly — porus zonatus, Collybia velutipes, Psalliota bispora. У всех этих грибов лакказа выделяется в окружающую среду, почему оии все дают реакцию Бавендамма на посинение введенной в среду гвая* кодовой кислоты (Lyr, 1958). Эта реакция отсутствует у возбудителей буровой гнили древесины, как. Coniophora cerebella (С. putea — na), Lentinus squamosus или Daedalea quercina. Их считали ранее неспособными образовывать полифенолоксидазы, однако в настоящее время выявилось, что многие из них, в частности возбудители бурой гнили из родов Polyporus и Coniophora, имеют внутриклеточную полифенолоксидазу, которую они не способны выделять в окружающую среду. В частности, это касается Coniophora puteana (Rosch, 1966).
Среди грибов — возбудителей белой гнили — продуценты внеклеточной лакказы встречаются очень часто, а среди обследован* ных Люром 103 видов дереворазрушителей их оказалось 47% (Lyr, Ziegler, 1959). Из Polyporus versicolor был получен и охарактеризован гомогенный препарат лакказы, которую он продуцирует очень обильно. Стимуляторами полифенолоксидазы оказались органические растворители, например 50%-й алкоголь, предположительно способствующий диссоциации требуемого для действия энзима компонента. Ингибиторами лакказы и, видимо, естествен
но ными ее регуляторами являются нуклеиновые кислоты, как РНК, так и ДНК, а также другие соединения пуринов. Предположительно они связывают входящую в состав фермента медь, а также и белковый компонент фермента. Лакказа Polyporus versicolor и P. zonatus оказалась эффективной в пределах pH от 3,0 до 6,5 с оптимумом действия при pH 5,0 и продукция ее специфически увеличивалась в 60 раз при введении в культуральную среду 33 мг/л йодида калия (Lindenberg, Fahreus, 1952).
Функция внеклеточной лакказы дереворазрушающих грибов начала разъясняться на модели грибов — возбудителей белой гнили древесины — в связи с выявлением роли фенолоксидазной системы в разрушении лигнина, сопряженной с целлюлозоразрушающей способностью этих грибов. Оказалось, что активность целлю — лаз при разложении древесины до конечного продукта, целлобио — зы, тесно связана с образованием фенолоксидазами хинонов и феноксирадикалов через действие энзима целлобиозохинонокси- .доредуктазы (Westermark, Eriksson, 1974). Это было показано на примере такого вида гриба — возбудителя белой гнили древесины, как Sporotrichum pulvirulentum, являющегося несовершенной стадией базидиомицета Phanerochaete chrysosporum. Окислительновосстановительная система этого гриба (типа лакказы) играет регулирующую роль в комплексных процессах разложения грибами лигнина и целлюлозы. Это было доказано тем, что мутант этого триба с дефицитом фенолоксидазы оказался способным разрушать лигнин только при добавке в его культуру лакказы (Ander, Eriksson, 1976). Механизм этой регулирующей функции, изученный на примере гриба Pleurotus ostreatus, состоит, видимо, в том, что промежуточный продукт разложения целлюлозы — целлобиоза ■окисляется с помощью дегидрогеназ (целлобиозохиноноксидоре — дуктаз) с восстановлением хинона в феноксирадикал, возникающий при деградации лигнина, заканчивающейся полимеризацией ■феноксирадикала и образованием меланина. Таким образом, целлюлозоразрушающая и лигнинразрушающая способности грибов оказываются тесно взаимосвязанными и взаимно регулирующими друг друга (Hiroi, Eriksson, 1976).
Лакказа считалась неспособной окислять ароматические аминокислоты типа тирозина или фенилаланина. Эту способность приписывали другому, близкому к ней по свойствам ферменту — ти — розииазе. Однако сейчас большей частью эти два фермента считают идентичными. Тирозиназа также содержит в качестве кофер — мента медь, что доказывается реактивацией ее ионами Си2+ при подавлении синильной кислотой.
Тирозиназа, играющая большую роль в обмене животных при образовании дигидроксифеиилаланина (ДОФА), предшественника гормонов надпочечников адреналина и норадреналина, очень распространена и у грибов микоризообразователей, таких как виды Boletus и Lactarius. Мякоти их плодовых тел свойственно синеть на изломе (у подосиновика, Boletus luridus, груздя, белянки и других видов Lactarius). Также синеет она у шампиньона.
Тирозиназа бывает как внеклеточной, выделяющейся в среду*, так и внутриклеточной, причем последняя была обнаружена у ряда дереворазрушающих грибов, как Polyporus schweinitzii и P. sulphureus (Rфsch, 1966). Роль ее у грибов, вероятно, в некоторых чертах сходна с ее ролью у животных, у которых продукты* образующиеся при действии тирозиназы (адреналин и норадрена — лин), принимают большое участие в явлениях проницаемости и. гомеостаза.
Поскольку регуляция проницаемости мембран особенно сильно — должна влиять на питание паразитных и микоризообразующих грибов, наблюдаемое обилие у них тирозиназы должно согласовываться с этой точкой зрения. Другим доказательством ее правильности является способность грибной тирозиназы образовывать из — L-тирозина или фенилаланина в присутствии аскорбиновой кислоты дигидроксифенилаланин (ДОФА)—предшественник адреналина животных. Продуктом дальнейшего действия тирозиназы на. ДОФА или окисленные производные индола оказываются конденсированные, соединения, укрупнение молекул которых ведет к образованию темного пигмента меланина и выявляется в форме — посинения мякоти плодовых тел на изломе. Сходным образом протекает меланиногенез у животных.
Другой тип меланинов, не содержащих азота, например у Dal — dinia concentrica, образуется возможно уже при участии лакказы из продуктов конденсации соединений типа стероидов или фенан — трена. Однако такие меланины у грибов более редки, а чаще у них обнаруживаются азотсодержащие, сформированные из фрагментов ДОФА или индола. Приписываемая меланинам экологическая роль состоит во всесторонней защите от повреждений в экстремальных условиях обитания, включая солнечную, особенно ультрафиолетовую радиацию, низкие и высокие температуры, сухость воздуха и субстрата. Защитный эффект меланина, по мнении» автора этой гипотезы (H. Н. Ждановой), неспецифичен и сводится к поддержанию нормального для грибной клетки уровня окислительно-восстановительного режима, pH и ионной силы, смещающихся под влиянием экстремальных воздействий (Жданова, 1976)*
Пероксидаза и каталаза. Среди оксидаз порфиринового типа, связанных как с кофактором с трехвалентным железом (Fe3+),. у грибов также обильно встречаются пероксидаза и каталаза^ Первая из них отщепляет кислород от органических перекисей, а вторая расщепляет перекись водорода с образованием атомарного кислорода и воды. Отличие этих ферментов от цитохромов заключается в том, что они не окисляют, а восстанавливают перекиси, вследствие чего их активная форма не восстановленная, а окисленная и функционирует соответственно реакции: Fe3+-* ->Fe2+, а производимая ферментом трансформация субстрата выглядит подобно реакции: НгОг-^-НгО+О (Lindenmayer, 1965). Оба’ этих фермента широко распространены у грибов. Каталаза была обнаружена у Pйnicillium chrysogenum, Aspergillus niger, Myrothe — cium verrucar. ia, Caldariomyces fumago (Shaw, Hager,1961), у ко-^ торого она участвует в системе окислительного хлорирования |3- кетоадипиновой кислоты и у базидиомицета Oudemansiella mucida. — Участвует она и в системе окисления глюкозо-6-фосфата в 6-фос — .фоглюконат у A. niger и других плесневых грибов (Андеркофлер, 19636). Пероксидаза, видимо, очень характерна для дереворазрушающих грибов из категории разрушителей ядровой древесины. Среди изученных Люром 103 видов грибов-дереворазрушителей образующими пероксидазу оказалось только 12%, против 47%, •образующих лакказу, и все они относились к разрушителям ядра древесины дуба или сосны.
Отсюда возникает предположение, что окисление циклических компонентов лигнина, разрушителями которого являются эти виды, зависит от наличия у них пероксидазы.
Особенно много пероксидазы’ оказалось у видов из рода Phellinus, в частности у Phellinus igniarius (Lyr, 1959). Грибная пероксидаза оказалась сходной с лакказой по их отношению к температуре, хотя и близкой по другим свойствам к растительной перок — сидазе. Например, у нее очень близкий к растительной пероксида — зе оптимальный pH (5,0—6,3) и температурный коэффициент Qio (повышение активности при увеличении температуры на 10°), близкий к 2,0. Реакция ускоряется три таком коэффициенте до ■50%>но, вообще, термостабильность энзима зависит от вида гриба, например, у Phellinus robustus энзим инактивируется на 50% при 77° С, а у Fomes annosus при 60°С. Этанол в концентрации 4% инактивирует энзим. ‘
Каталаза и пероксидаза обильно накапливаются в мицелии Pйnicillium chrysogenum в процессе ферментации пенициллина, но главным образом внутриклеточно, а в среду выходят только в конце роста в начале автолиза клеток мицелия (Маттисон, 1956).
При анализе пероксидазной активности у грибов дейтеромице — тов, живущих на опавших листьях и на хвойном опаде, оказалось, что от 30 до 60% из их числа обладают этой способностью, особенно при выращивании их на субстратах пероксидазного окисления, таких как таннин, галловая кислота, пирогаллол, аскорбат или отвар дубовой коры. Те же виды почвенного происхождения обладали этой способностью не более чем в 1,6% случаев (Борисова, Двойное, 1972). К числу видов грибов, обладающих высокой пероксидазной активностью, относились виды рода Cladosporium (С. gossypicola, С. transchelii, С. ovorum) и Botryiis cinerea, особенно активные при выращивании на средах с отварами из листьев березы и дуба.
Из других пероксидаз грибов можно назвать хлорпероксидазу, обнаруженную у Caldariomyces fumago, которая осуществляет трансформацию 0-кетоадипиновой кислоты в б-хлорлевулиновую кислоту (Shaw, Hager, 1961). Однако этот процесс, оптимизирующийся при очень низких уровнях pH (pH 2,8), происходит многоэтапно, причем хлоропероксидазой осуществляется только последний этап — окисление с замещением кислорода хлором. В предшествующих этапах этой реакции, которая возможна только в
присутствии всех компонентов комплекса, принимают участие: гидролаза, выщепляющая глюкозу из запасных полисахаридов, клетки; глюкозооксидаза, окисляющая эту глюкозу до глюконовой кислоты; каталаза, расщепляющая выделяющуюся при окислении глюкозы перекись водорода на воду и кислород, который в момент выделения с помощью хлорпероксидазы реализует использование хлор-иона для хлорирования Я-кетоадипата (Shaw, Hager, 1961).