Основным обменом называют этапы обмена веществ, необходимые для поддержания жизни, роста и размножения организмов. Главной чертой его является менее выраженная специфичность, по сравнению с боковыми путями обмена. Он, в общем, сходен у всех живых существ и чаще отличается лишь некоторой возрастной специфичностью. Например, эмбриональные ткани получают энергию преимущественно через гликолитический путь Эмбден — Мейергофа — Парнаса (ЭМП), тогда как более зрелые характеризуются более развитым пентозным циклом или циклом гексо — зомонофосфата (ГМФ).
В качестве примера этого положения из области грибов могут служить прорастающие хламидоспоры Ustilago maydis, которые через 12 ч после начала их проращивания еще не имеют энзимов для усвоения сахаров через путь ГМФ и ферментов цикла Кребса, но уже обладают комплексом энзимов, участвующих в усвоении сахаров по пути ЭМП (Blumental, 1965). В спорах Tilletia caries имеется только серия энзимов для метаболизма сахаров по пути
Энтнер — Дудорова (ЭД), в котором отсутствует фосфорилирова — ние глюкозы, тогда как в мицелии вместо них обнаруживаются энзимы, действующие при метаболизме сахаров через пути ЭМП и ГМФ.
У больших таксономических групп, стоящих на сильно удаленных друг от друга ступенях филогенеза, степень развития отдельных этапов основного обмена может также довольно резко отличаться. Например, у оомицетов цикл Кребса, видимо, развит слабо, так как они используют предпочтительно для питания уже готовые аминокислоты. У паразитов часто выявляются вторичные дефекты, связанные с паразитарным образом жизни.
Хотя у грибов и встречаются исключения экологического происхождения в форме сильных изменений первых этапов основного обмена, например сильное преобладание в обмене СаШагютусеэ fu. ma. go редко встречающегося типа гликолиза по пути ЭД, однако основной обмен меняется реже в зависимости от экологических условий, чем его боковые пути. Он обычно не имеет видовой или групповой специфичности, характерных для узких таксономических групп грибов, обитающих в сходных экологических условиях. Видовая или групповая специфичность обмена проявляется чаще всего в закрепленных филогенетически приспособлениях, развившихся в результате экологических воздействий в боковых ветвях метаболизма, необязательных для роста и развития, накопления биомассы и деления клеток, но необходимых для приспособления к среде обитания, как например, образование антибиотиков, токсинов, витаминов, ферментов специального назначения, чаще всего гидролитических и других специфических ‘продуктов метаболизма.
Пути гликолиза у грибов. В настоящее время исследовано четыре вида путей гликолиза у грибов, являющихся первыми этапами их углеродного обмена. Эти пути следующие: путь ЭМП, путь ГМФ или пентозный (апотомический) цикл, путь ЭД и глюкуро — натксилулозный (ГК). Не исключается открытие и новых путей гликолиза у грибов.
Путь ЭМП, который был изучен первым и оказался наиболее широко распространенным, характерен промежуточным метаболизмом через образование на первом этапе фруктозо-1,6-дифосфата (рис. 3.1). На втором и параллельном ему третьем этапах происходит дальнейшая трансформация триоз, полученных после действия альдолазы.
Пировиноградная кислота — конечный продукт процесса гликолиза — включается далее в метаболизм цикла ТКК. Однако еще не доходя до цикла ТКК, у многих грибов пировиноградная кислота может восстанавливаться при помощи НАДНг-дегидрогеназы до молочной кислоты. Это превращение носит название молочнокислого брожения.
Четвертый этап составляет превращение пировиноградной кислоты при действии декарбоксилазы с кофактором тиаминпирофос — фатом (ТПФ) в ацетальдегид и далее при действии НАДН2-дегид — рогеназы в этиловый спирт и носит название спиртового брожения.
|
СОН НСОН НОСИ, НСОН НСОН СН20Р03Н2 Глю ко зоб-фосфат |
|
(2) |
|
(АТФ, Мд2+) |
|
(4) |
|
С Н20Н |
|
1, |
|
(надн2) |
|
► 2. СНОН 3. СН20Н Глицерин СООН НСОН |
|
— |
|
С6) |
|
и. ип———————— ■’•т. ип————————— —————————- гтп1,ип СН,0Р03Н2 (АТФ, Мд2; СН,0Р03Н2 (АД<Р’М9 ‘ СН,0Р03Н. 2 3 2 НАД^п2*) 2 3 2 2 ‘ |
|
‘2й 3 2 3-фосфогли- цериноВая кислота |
|
1. СН20Р03Н2- 2. С=0 , ‘з. сн2он. Диоксиацетон — I фосфат I ч4. СОН 5. НСОН |
|
Глицеральдегид■ 3-фосфат |
|
&сн2он а.-Шицерофосфат СООРО, Н, ►. НСОН ■ |
|
"2игиЗП2 1,3-дифосфо- глицериноВая кислота |
|
Ч<СН_0Р03Н, |
|
2.СН0Н |
|
6. |
|
1. СН20Р03Н 2. С=0 3. нос н £2 4. НСОН (1п2*) 5. НСОН |
|
СН20Р03Н2 |
|
1. НСОРО? Н. 2. НСОН 3. носн. 4. НСОН I 5. 6. Глюкоза- 1-фосфат |
|
3 2 |
|
(1) |
|
(АТФ, Щ2*) |
|
НСОН СН20Н |
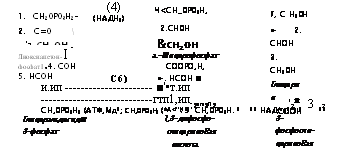 |
|
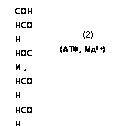 |
|
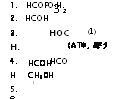 |
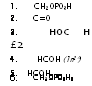 |
|
|
С 7)
МКБ
|
I СООН снон-*- СН3 Мило иная кислота |
|
(9) |
|
(АМф,, Щ2*) |
|
(НАД Н2,2п2+) |
|
3;4 СООН — 2; 5 С=0 *—- 1; 6 СН3 ПироВиноградна? кислота (ТПФ)|(10) |
|
Л) |
|
(НАДН2,гп2+) |
|
1; 6 СН3 ‘ 2; 5 СОН |
|
Ацеталь- дегид |
|
сн3 сн2он ЗтилоВый спирт | |
|
СД |
|
СОН НСОН СН20Н Глицеральдегид |
|
СН3 I 3 + СОН ■ |
|
неон I Ацеталь — СН20Н дегид Деэокси- рибоза |
|
сон сн2 I 2 >нсон |
|
СООН СН0Р0,Н. |
|
‘3‘ ‘2 СН20Н 2-фосфогли- цериноВая кислота |
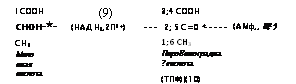 |
|
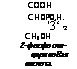 |
|
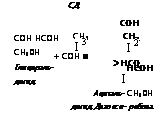 |
|||
|
|||
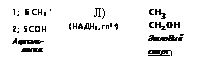 |
|||
|
|||
СБ
Рис. 3.1. Метаболизм глюкозы через путь ЭМП. Участвующие в цикле ЭМП энзимы: / — гексокиназа; 2 — фосфоглюкокина — за и глюкозофосфатизомераза; 3 — альдолза; 4 — диоксиацетонфосфатдегидрогеназа; 5 — глицерофосфатаза; 6 — глице — ральдегид-3-фосфатдегидрогеназа; 7 — фосфоглицераткиназа; 8 — э:толаза (фосфоэнолпируватгидратаза); 9 — козимаза; 10 — декарбоксилаза; II — козимаза. Кофакторы энзимов показаны п местах их действия. Распределение атомов углерода
глюкозы обозначено порядковыми номерами
Пятая трансформация в пределах пути ЭМП — это образование путем конденсации ацетальдегида и глицеральдегида сахарного ■компонента ДНК — дезоксирибозы, очень необходимой для основного обмена нуклеиновых кислот.
Путь гликолиза через ГМФ, или пентозный цикл, осуществляется через образование из глюкозы на первом этапе глюконолак — тона и из него .глюконовой кислоты (рис. 3.2).
|
СР |
![]() ГКБ
ГКБ
|
У**, СОН |
|
3. сн2он 4. С=0 — 5. НСОН 6. CH20P0jH2 |
|
у г НСОН CH20P0jH, |
|
(ТПЧ>) |
|
II гг*-» |
|
СС |
|
с=о | неон §>« неон Ь & і § Й НСОН в ^ I І* неон СН20Р0,Н |
|
сн, он |
|
3 2 |
|
сон сн. он •а ‘2 *§ Qj І? а л >5§ |
|
(2) |
|
(3) |
|
И/ |
|
4- Н<Г0Н (АТ4>, Мд2+) ’ Н(;0Н (ФАД. Бн/ Н(;0Н (НАДДПФ)" 4’Н(?0Н С илли илли иллі I г — МАЛИ |
|
5. НС0Н 6. CH20P0jH2 РиЗулозо- 5-фосфат |
|
сн2он |
|
5. НСОН I ‘6. Глюкозо- Л-фосфат |
|
1. HC0P0jH2 2. НСОН 3. НОСН |
|
НСОН CH20P0jH Глюкозоб-фосфат |
|
СОН неон HOCH |
|
НСОН СН20Р05Н2 В-фосфо- глюконат |
|
соон неон HOCH I |
|
2. СН. ОН I 2 3. с=о I |
|
СОН неон "неон неон СН20Р03Н2 РиЗозо- 5-фосфат |
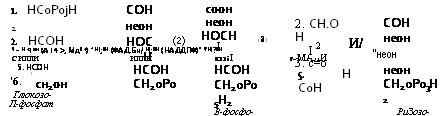 |
|
|
|
 |
Рис. 3.2. Метаболизм глюкозы через путь ГМФ, или пеитозный цикл. Участвующие в пути ГМФ энзимы: 1 — гексокииаза; 2 — глюкозофосфатоксидоредукта — за; 3 — фосфоглюкоиатдегидрогеиаза и декарбоксилаза; 4 — рибулозо-5-фосфа — тизомераза; 5 — рибулозо-5-фосфатдекарбоксилаза; 6 — эритрулозо-4-фосфат — декарбоксилаза; 7 — траискетолаза; 8 — траисальдолаза или траискетолаза.
Распределение атомов углерода глюкозы обозначено порядковыми номерами
Второй этап пентозного цикла состоит в трансформации рибу — .лозо-5-фосфата по двум альтернативным путям (рис. 3.2). Фермент траискетолаза, способный переносить с одного сахара на другой двухфрагментные группы углеродных соединений, содержащие кетогруппу, очень типичен для пути ГМФ.
Третий этап пентозного цикла состоит в конденсации с помощью трансальдолазы эритрулозо-4-фосфата и глицеральдегид-3-фосфата
в сахар седогептулозу, функционирующую как резервный источник для образования серии сахаров с различным числом атомов углерода. Седогептулоза может образовываться также путем переноса двууглеродного фрагмента транскетолазой на пентозу. Возможны и другие перекомбинации, осуществляемые транскетолазой и транс — альдолазой.
Цикл метаболизма по пути ГМФ распространен почти так же широко, как и цикл ЭМП, и имеет весьма разнообразное назначение, поскольку: 1) он необходим для образования рибозы, а следовательно, для синтеза РНК, 2) с его помощью создаются запасы разнообразных сахаров, пригодных для дальнейших перестроек (седогептулоза) и синтезов, 3) он обеспечивает материалом биосинтезы ароматических аминокислот из эритрозо-4-фосфата.
Путь метаболизма глюкозы по Энтнер — Дудорову был обнаружен в связи с выявлением видов грибов, совершенно лишенных фосфогексокиназы, фермента фосфорилирующего гексозы. Calda — riomyces fumago и прорастающие споры головни Tilletia caries
|
1. сон |
1. СООН | |
1. СООН |
1. СООН |
|
1 2. НСОН |
2. НСОН |
j 2. НСОН |
to -ri ll О |
|
1 3. HOCH (1) |
| 3. НОСН (2) |
j 3. HOCH (3) |
3. СНа |
|
1 —* |
1 (АТФ) ‘ |
1 —*■ |
1 |
|
4. НСОН |
4. НСОН |
4. НСОН I |
4. НСОН |
|
1 5. НСОН |
| 5. НСОН |
5. НСОН |
j 5. СОН |
|
j 6. СН2ОН |
j 6. CHjOH |
6. СН20Р03Н2 |
j 6. СН2ОР(ОН)3 |
|
Глюкоза |
Глюконовая |
6-фосфоглюконат |
2-кето-З-дезокси-6- |
|
кислота |
фосфо-D — глюконат |
||
|
(4) 1 |
|||
|
1 |
|||
|
4. СОН |
1. СООН |
||
|
Q4)02-< |
| !————- 5. НСОН |
to -ri ll 0 1 |
■С(,)02 |
|
| 6. СН20Р03Н2 |
3. CH» |
||
|
Г лицеральдегид- |
Пируват |
|
З-фосфат Рис. 3.3. Метаболизм глюкозы через путь ЭД и распределение в его продуктах атомов углерода этого моносахарида (обозначены порядковыми номерами). Участвующие в пути ЭД энзими: 1 — глюкозооксидаза; 2 — глюконаткиназа; 3 — б-фосфоглюконатдегидрогеназа; 4 — 2-кето-З-дезоксиглюконатальдолаза (В1и- тепіаі, 1965) |
оказались способными окислять нефосфорилированную глюкозу в глюконовую кислоту с помощью глюкозооксидазы и фосфорили — ровать уже глюконат при действии глюконаткиназы (рис. 3.3). Конечные продукты цикла ЭД могут далее включаться в циклы
ЭМП и ГМФ, а также в цикл трикарбоновых кислот. Этот путь метаболизма углеводов встречается у грибов сравнительно редко.
Глюкуронат-ксилулозный путь метаболизма углеводов заключается в окислении глюкозы в глюкуроновую и далее гулоновую кислоту, дающую затем начало аскорбиновой кислоте (рис. 3.4). Э-рибулозо-б-фосфат может включаться в цикл ГМФ.
|
1. |
![]()
|
4. 5. 6. |
![]()
|
2. |
![]()
|
3. HOCH |
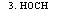
|
4. 5. |
![]()
|
Ксилитол |
СОН
2. НСОН
!
3. HOCH (/>
I —
4. НСОН
5. НСОН
I
6. СН2ОН Глюкоза
1. СОН
I
2. НСОН
3. HOCH (2)
I———- *
4. НСОН
I
5. НСОН
I
6. СООН
D-глюкуроновая
кислота
1. СН2ОН
2. НСОН—С(6)02
I
3. HOCH (3)
(ТПФ)
НСОН
COOH
L-гулоновая
кислота
СН, ОН
I
НСОН
НСОН
I
СН2ОН
SHAPE \* MERGEFORMAT 
|
1. |
СН2ОН г |
1. |
СН2ОН і |
1. СН2ОН~ |
|
2. |
1 с=о |
2. |
1 с=о |
1 2. С=0 |
|
3. |
НСОН (б) |
3. |
1 HOCH, (5) |
1 3. HOCH |
|
4. |
1 НСОН |
4. |
1 * (АТф) НСОН |
1 4. НСОН |
|
5. |
1 СН2ОР(ОН)2 |
5. |
1 СН2ОР (ОН)2 |
1 5. СН2ОН |
|
Рибулозо-5-фосфат |
О-ксилулозо-5-фос- |
D-ксилулоза |
|
4 Аскорбиновая кислота |
|
фат |
|
Рис. 3.4. Метаболизм глюкозы через глюкуроиат-ксилулозный путь и распределение в продуктах метаболизма ее атомов углерода (обозначены порядковым® номерами). Участвующие в пути ГК эизимы: / — глюкозодегидрогеназа; 2 — глюкуронатредуктаза; 3 — гулонатдекарбоксилаза; 4 — ксилитолдегидрогеназа; 5 — фосфокиназа; 6 — изомераза (В1ите1Йа1, 1965) |
|
(4) |
![]() Этот путь метаболизма имеется у Aspergillus niger, так как добавление в его культуру глюкуронолактона вызывает у него увеличение количества аскорбиновой кислоты втрое, выход которой составляет 2,6%. Рост мицелия при этом увеличивается всего на 18% (Sastry, Sarme, 1957). Количественное значение этого пути метаболизма пока еще не изучено и, вероятно, он является «минорным», поскольку объем его невелик. Тем не менее значение его в обмене важно как ведущего к образованию аскорбиновой кислоты. Кроме A. niger он, видимо, функционирует также у Pйnicillium chrysogenum и у дрожжей.
Этот путь метаболизма имеется у Aspergillus niger, так как добавление в его культуру глюкуронолактона вызывает у него увеличение количества аскорбиновой кислоты втрое, выход которой составляет 2,6%. Рост мицелия при этом увеличивается всего на 18% (Sastry, Sarme, 1957). Количественное значение этого пути метаболизма пока еще не изучено и, вероятно, он является «минорным», поскольку объем его невелик. Тем не менее значение его в обмене важно как ведущего к образованию аскорбиновой кислоты. Кроме A. niger он, видимо, функционирует также у Pйnicillium chrysogenum и у дрожжей.
Описанные здесь четыре типа гликолитических процессов, вероятно, еще не исчерпывают всего разнообразия первых этапов
углеродного метаболизма грибов. Например, известен в настоящее время путь окисления галактозы в галактуроновую кислоту, далее трансформирующуюся в галактодиальдозу. Такой путь окисления был обнаружен у дереворазрушающего базидиомицета РоІурогиБ сігсіпаіиз (Віитеггіаі, 1965). Вероятно, его обнаружения следует ожидать и у других видов.
|
2-кетоглюконат- киназа |
 Между отдельными путями гликолиза имеется связь, позволяющая обойти через включение альтернативных путей обмена затруднения из-за дефицита какого-либо энзима. Например, дефицит включающейся в обычный путь ЭМП гексокиназы у СаЫагютусеэ fumago компенсируется возможностью исходить из образующегося без фосфорилирования глюкозы 6-фосфоглюконата или 2-кето-6- фосфоглюконата с последующим включением продуктов обмена в путь ЭМП или ГМФ (рис. 3.5).
Между отдельными путями гликолиза имеется связь, позволяющая обойти через включение альтернативных путей обмена затруднения из-за дефицита какого-либо энзима. Например, дефицит включающейся в обычный путь ЭМП гексокиназы у СаЫагютусеэ fumago компенсируется возможностью исходить из образующегося без фосфорилирования глюкозы 6-фосфоглюконата или 2-кето-6- фосфоглюконата с последующим включением продуктов обмена в путь ЭМП или ГМФ (рис. 3.5).
|
2-кетоглюконат |
||
|
Гексо- |
Глюконат- |
редуктаза |
|
киназа |
киназа |
|
Глюкозооксидаза или Глюконатдегидро- глюкозодегидрогеназа геназа |
|
Глюкоза—————————— НГлюконат 2-кетоглюконат |
|
Глюкозо-__________________ 6-фосфат — __________________ |
|
6 фосфат гЛЮКОЗо-б-фосфатде — глю^онат 2-кето-6-фосфоглю — нат гидрогеназа конатредуктаза |
Путь ____________________ Путь_ ГМФ и/или
ЭМП ~*"путь ЭД
Рис. 3.5. Взаимосвязь различных путей метаболизма гексоз и гексоновых кислот у грибов (В1ите1Йа1, 1965)
Количественное соотношение разных путей гликолитического обмена у различных грибов отличается друг от друга, но большей частью у них преобладает путь ЭМП. Путь ГМФ известен как ведущий, или равноценный пути ЭМП, у немногих видов, например Pйnicillium charlesii, P. urticae, Usiilago maydis, Tilletia contra — uersa и y ряда актиномицетов.
Путь ЭД известен пока только у двух видов: С. fumago и
T. caries. Однако возможно, что впечатление о преобладании в гли — колитическом обмене пути ЭМП является результатом краткосрочных опытов или других условий культивирования, так как есть сведения, что путь ГМФ развивается позднее, чем путь ЭМП, в процессе дифференцировки вегетативного мицелия.
Преобладание тех или иных путей гликолиза может очень сильно зависеть от композиции питательной среды и степени доступности необходимых для гриба энергодающих систем, минеральных компонентов, микроэлементов или витаминов. В частности, это, видимо, сильно связано с относительными концентрациями серы и фосфора в среде. Поскольку путь ЭМП основан на образовании
|
67 |
![]() •3*
•3*
двукратно фосфорилируемых соединений, как глюкозо-1,6-дифосфат и фруктозо-1,6-дифосфат, для него требуется более интенсивное снабжение фосфатом. Напротив, для пути ГМФ, по которому фос- форилирование протекает только однократно при образовании глюкозо-6-фосфата, фосфора требуется меньше, но зато необходимо повышенное снабжение сульфатом ввиду участия в нем SH-групп и тиамина.
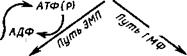
Из работы Дмитриевой (1967) на примере Pйnicillium chryso — genum следует, что сдвиг баланса Р : S в пользу фосфора приводит к замедлению развития миделия, видимо, сопровождаемому преобладанием пути ЭМП, а сдвиг его в пользу серы — к ускорению развития с очевидным преобладанием в гликолитическом обмене пути ГМФ. Косвенными гистохимическими доказательствами наличия метаболизма по пути ЭМП при избытке фосфора в среде являются большое накопление в клетках мицелия P. chrysogenum волютина, состоящего из полифосфатов, и стимуляция синтеза ДНК, выражающаяся в учащении деления ядер. Усиление обмена ДНК объясняется синтезом по пути ЭМП дезоксирибозы, которая является одним из факторов, лимитирующих биосинтез этой нуклеиновой кислоты, а накопление полифосфатов сигнализирует а высоком уровне фосфорилирования и расхода фосфорной кислоты в обмене (рис. 3.6).
Подтверждением преимущественного метаболизма по пути ГМФ[3] при избытке серы в среде является преобладание в мицелии продуцента пенициллина волютина, состоящего из РНК, что связано с усилением синтеза рибозы, одного из важнейших факторов, регулирующих биосинтез рибонуклеиновой кислоты. Это совпадает с одновременной значительно большей продукцией серосодержащего антибиотика P. chrysogenum — трипептида пенициллина, включающего в состав молекулы цистеин. В условиях нормального оптимального баланса Р : S состояния мицелия, характерные для преобладания фосфора в среде и для сдвига баланса в пользу серы, последовательно сменяют друг друга в онтогенезе, что указывает на связь пути ГМФ (по мнению биохимиков, филогенетически более позднего) с возрастной дифференциацией и развитием экологических приспособлений в форме продукции антибиотика.
Сходные явления наблюдались и у актиномицетов, продуцентов тетрациклинов, например у Streptomyces rimosus. Низкая продуктивность сопровождалась у него угнетением цикла ГМФ, выражающимся в падении активности фосфоглюконатдегидрогеназы, и усилением пути обмена по ЭМП, о чем можно было судить по усилению активности его энзимов и по накоплению пирувата в среде.
Энергетическое значение путей гликолиза относительно невелико. Общее их назначение состоит в основном в подаче метаболитов для дальнейших биосинтезов, необходимых для нормального обмена. Вещества эти могут быть следующими: 1) составляющие фрагменты, необходимые для синтеза клеточных оболочек: глю — козамин-6-фосфат или УДФАГ для биосинтеза хитина, УДФ-глю-
|
S>P |
|
и актибные штаммы |
|
|
|
|
|
|
|
АДФ Глюкоза 6Р |
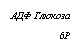
|
ФАД I +5H(S) "Н2 |
Морфо
генетический
эффект
Волютин ПФ —»
[ РНК
ПФ
Глюкоза 1,6 РР
Фруктозо 1,6 РР
69 глюконат ТПФ(і) — С02
Рибу лозо SP ТПФ($ )|
К
Морфо —
генетический
Эффект
|
|
|
Гпицеральдегид ЗР |
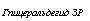
|
Лируват І — м2 1 T/1<P(S) |
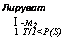
|
Ацетальдегид |
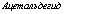
|
ДНК |
![]()

|
Дезокси рибоза |
ИнтенсиЬное деление -*■ ядер
Рибозо S?
Эритрулозо і 4P * Tfl<P(S) РНК
І Л. ШЖІЖ Возрастные (разы
Волютин РНК
Рост,
торможение деления ядер 6 телофазе
Торможение развития Ф І-tu (непродуктивных) фазах. Мало антибиотика быстрый переход 6 IV — VI (продуктивные) фазы и длительное пребывание в этом состоянии. Много антибиотика
Рис. 3.6. Свизь морфогенеза, гликолитического обмена и активности пеиицилииа в погруженной культуре Pйnicillium chrysogenutn с преобладанием фосфора
или серы в среде
коза для биосинтеза глюканов, гликогена и клетчатки, манноза при синтезе маннана, сахара, участвующие в первых этапах гликолиза; 2) пентозы, необходимые для синтеза нуклеиновых кислот: дезоксирибоза для биосинтеза ДНК, образующаяся по пути ЭМП, рибоза для биосинтеза РНК, образующаяся по пути ГМФ; 3) запасные вещества для эндогенного получения энергии: УДФ-глю — коза, гликоген, жиры, глицерин и ацетальдегид; 4) метаболиты
для синтезов в пределах цикла трикарбоновых кислот: ацетальде — гид и пируват — источники для биосинтеза аминокислот и белка; 5) метаболиты для синтеза ароматических аминокислот: эритру — лезо-4-фосфат, синтезирующийся по пути ГМФ; 6) метаболиты для биосинтеза терпенов, жиров и ароматических соединений, не содержащих азота, и т. д., такие как пируват, адетальдегид и некоторые вещества, образующиеся по пути ГМФ.
Гликолитические пути метаболизма слабо функционируют как источники энергии, так как выход энергии в них в 20—30 раз ниже, чем в дыхательной цепи, связанной с циклом Кребса. Они играют в основном конструктивную роль в обмене веществ, поставляя разнообразные низкомолекулярные фрагменты для обеспечения различных более сложных синтезов в процессе роста и развития живых организмов, в том числе и для многочисленных боковых путей обмена, лежащих в основе их приспособлений к среде обитания.
Цикл ди — и трикарбоновых кислот Кребса. Необходимость этапа основного обмена через цикл Кребса обусловлена тем, что он дает основной материал для синтеза протеина, нуклеиновых кислот (пуринов и пиримидинов) и различных кофакторов ферментов белков, т. е. витаминов. Реакции цикла Кребса широко распространены среди грибов. Они установлены у 51 вида из всех основных классов грибов (Ы1ебегргиет, 1965), но интенсивность его функционирования различна у разных представителей этого царства. Также, видимо, не у всех форм грибов представлены все реакции цикла ТКК.
Была сделана попытка связать распространение этого обмена с филогенией грибов. При этом обнаружилось, что среди низших грибов более примитивные одножгутйковые формы характеризуются гомоферментным обменом, т. е. образуют большей частью из глюкозы молочную кислоту, и имеют слабо функционирующий цикл ТКК. Исключение составляет только род АИотусеэ— выраженный аэроб с сильно развитым циклом Кребса. Однако двужгутиковые оомицеты из семейств Барго^шакэ и Ьер1огшсе1а1ез тоже слабо образуют органические кислоты, формирующиеся, в цикле ТКК.
Исследование обмена по циклу Кребса у грибов проводится теми же путями, что и при изучении процесса гликолиза. Оценка по анализу ферментативных систем цикла ТКК затрудняется тем, что большинство его ферментов, в противоположность ферментам путей гликолиза, находящимся в цитоплазме, локализуется в органоидах клетки — митохондриях, легко разрушающихся при их изоляции в бесклеточных экстрактах грибов. При работе с этими ферментами потребовалась разработка специальных мягких методов выделения митохондриальных фракций клеток и последующего отделения ферментов от структурных белков митохондрий, с которыми они связаны, без потери их активности. Для этого было применено быстрое механическое разрушение клеток в подходящем растворителе, заключение их в раствор сахарозы, препятствующий набуханию митохондрий, удаление вредных металлов и т. д. Дыхательные гранулы из митохондрий, активно дышащие и красящиеся гН-индикаторами, например янусом зеленым, были выделены из Allotnyces tnacrogynus, Candida albicans, Fusarium lini, Aspergillus oryzae, Myrothecium oxysporum, Neurospora crassa и ряда других грибов (Niederpruem, 1965). У A. macrogynus и A. oryzae были также выделены митохондрии, способные производить окислительное фосфорилирование.
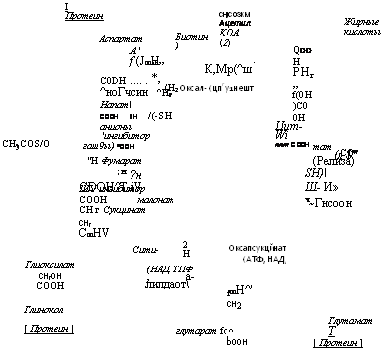
Последовательность реакций цикла дикарбоновых и трикарбо — новых кислот (ТКК) или цикла Кребса помещена на схеме рис. 3.7.
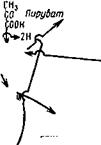
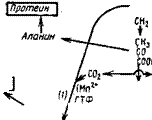
В первом этапе с помощью конденсирующего энзима в молекулу фосфоэнолпирувата включается молекула углекислоты, в результате чего образуется оксалацетат с четырьмя атомами углерода.
Второй этап состоит в конденсации оксалацетата с ацетильной группой с образованием шестиуглеродной лимонной кислоты. Кофакторами этой синтетазы являются коэнзим А, ионы К+ и Mg2+. Цитратсинтетаза была выделена из Aspergillus niger и из дрожжей, но у A. niger она несколько отличалась от дрожжевой, так как не стимулировалась, а угнеталась ионами Mg2+.
В третьем этапе цикла ТКК происходят внутренние перестройки, приводящие к преобразованию цитрата сначала в цисаконито — вую, а затем в изолимонную кислоту. Оба этих этапа полностью обратимы. В первом из них может участвовать высокомолекулярная аконитгидратаза, не активируемая ионами Fe3+ и SH-rpynna — ми. Тот же процесс трансформации цитрата в цисаконитат и обратно и последующий из цисаконитата в изоцитрат может осуществлять и другой низкомолекулярный фермент—аконитаза, активируемая ионами Fe3+ и SH-группами.
В четвертом этапе цикла Кребса изоцитрат окисляется изоцит — ратдегидрогеназой в оксалсукцинат. Кофакторами этого фермента являются НАДФ и металлы Мп2+ или Mg2+. При этом происходит первый сброс двух атомов водорода в дыхательную цепь с выходом энергии.
В пятом этапе цикла ТКК происходит декарбоксилирование оксалсукцината с участием связанной с НАД, НАДФ, Мп2+ или Mg2+ изоцитратдегидрогеназы, приводящее к образованию пятиуглеродной а-кетоглутаровой кислоты. Производящий эту трансформацию фермент был изучен у дрожжей и у Л. niger, у которого он связан с НАД и более лабилен в отношении температуры. Ферменты этого этапа тесно связаны с митохондриями и требуют для поддержания их активности присутствия АТФ или ортофосфата. Образующийся в этом этапе а-кетоглутарат при его аминировании дает начало образованию глутаминовой кислоты, включающейся далее в синтез белков. Однако при недостатке восстановленных форм азота а-кетоглутаровая кислота метаболизируется далее.
Шестой этап трансформации метаболитов цикла ТКК состоит в декарбоксилировании а-кетоглутарата и одновременной конденсации образовавшегося сукцината с коэнзимом А. Эта реакция осуществляется с помощью а-кетоглутаратдегидрогеназы, производящей окислительное декарбоксилирование при участии в каче-
|
I УглеВоды~~ ♦ Гликолиз СООН Фоссроэнол — С0Р(0Н)2 пируВат |
|
[ЛипиЬы | ‘ |
|
X Пальмитинобая кислота f ООН Малонил КоА СНCOS КОА |
|
,ь„ . К, Мр(^ш*, (Н2 Оксал — (цпгу1нешт ацетат у л njger) |
|
Жирные кислоты |
|
I Протеин |
|
Аспартат |
|
Биотин) |
|
C0DH……. ^ноГчсин ^Нг Напат СООН 2Н /(-SH анионы, ‘ингибитор гаш9ы) ^ООН "Н Фумарат ;н? н CDOH^T. iV |
|
CHjCOSKM Ацетил КОА (2) |
|
А ‘ f (J00H |
|
тат |
|
СООН |
|
(Релиза) |
|
(НАД, ТПФ, а-лилдаот |
|
CH3COS/OM Ацетил КоА |
|
SH) Ш — И» ч~Гнсоон |
|
ШУ ингибитор СООН малонат} СН г Сукцинат снг C00HV |
|
2Н |
|
Сити- |
|
глутарат fco Ьоон |
|
Оксапсукцйнат (АТФ, НАД, |
|
Глутамат Т | Протеин ] |
|
Глиоксилат снгон СООН Глинокол [ Протеин | |
|
f00H^’ сн2 |
|
(В) |
|
Q00H Цит-Wi (л $т ■ fHj . ссоон Акони-l н |
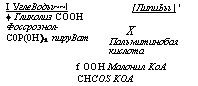 |
 |
![]()

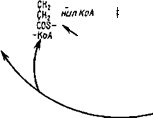
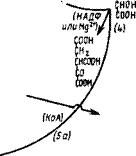
Рис. 3.7. Цикл Кребса (модификация, составлениаи по даииым №е(1егргиет, 1965). В скобках приведены кофакторы и стимуляторы активности данного энзима. Участвующие в цикле Кребса эизимы: 1 — пируваткарбоксилаза; 2 — цитратсиитетаза; 3 — акоиитаза; За — акоиитгидратаза; 4— изоцитратдегидро — геиаза; 5 — изоцитратдекарбоксилаза; 5а — изоцитратаза; 6 — а-кетоглутарат — дегидрогеиаза; 7 — сукцииатдегидрогеназа; 8 — фумараза; 9 — малатдегидро-
геиаза
стве кофакторов А^2+, 2п2+, ТПФ, НАД, а-липоевой кислоты и КоА, содержащего БН-группу. При этом происходит освобождение энергии, сопровождающее второй сброс в дыхательную цепь двух атомов водорода и образование четырехуглеродного метаболита
(сукцината) в цикле ТКК. Поскольку производящий эту реакцию фермент имеет в своем составе КоА и, следовательно, SH-группы, при утрате им активности под влиянием арсеиита она может быть возвращена при действии тиоловых соединений. Ферменты этого этапа также содержатся в митохондриях и были получены из мицелия A. niger (Ramakrishnan, 1954, цит. по Niederpruem, 1965).
В следующем, седьмом, этапе цикла ТКК сукцинил коэнзим А трансформируется в сукцииат и с помощью сукцииатдегидрогеназы, содержащей в качестве кофакторов флавииовый нуклеотид, 4 молекулы негемового Fe3+ на молекулу энзима и SH-группы, трансформируется в фумаровую кислоту. При этом происходит третий сброс двух атомов водорода в дыхательную цепь и третий случай освобождения энергии в процессе прохождения этого цикла. Сук — цинатдегидрогеназа была получена в виде препарата 65% чистоты из дрожжей, а также была выделена из ряда гифообразующих грибов таких, как Aspergillus niger, Neurospora crassa, Myrotheci — um verrucaria, Penicillium chrysogenum и Claviceps purpurea. Энзим из С. purpurea оказался сходным с соответствующим энзимом млекопитающих по оптимальной активности при pH 7,7 и конкурентному подавлению его фумаратом, пирофосфатом и малонатом. Однако в противоположность энзиму из млекопитающих, эизим из Claviceps мало реагировал на действие фосфата.
Восьмой этап цикла Кребса состоит в гидрировании фумаровой кислоты с помощью фумаразы и в превращении ее в яблочную кислоту (малат). Фермент фумараза стимулируется двух — и трех — валеитными анионами и SH-группами, ио подавляется одновалентными анионами, такими как галоиды и CNS. Этот фермент был выделен из A. niger и из ряда дрожжей. У дрожжей Candida utilis он существует в двух формах с разным оптимальным pH для их активности. Обе формы удалось разделить с помощью электрофореза.
Последний, девятый, этап цикла ТКК состоит в окислении ма — лата в оксалацетат, что осуществляется с помощью фермента ма- латдегидрогеиазы, которая относится к дегидрогеназам а-гидрок — сикарбоксиловых кислот и имеет в качестве кофактора НАД. Эта дегидрогеназа была получена в виде сто — двестикратно очищенного препарата из супернатанта гомогената клеток дрожжей, т. е., видимо, ие связана с митохондриями. У Neurospora crassa были найдены четыре изозима этого фермента (Niederpruem, 1965), а у Uготу ces phaseoli (U. appendiculatus) найдено три таких изозима в его уредоспорах. В этом этапе происходит последний, если ие считать момента включения С02 в пируват, четвертый, сброс двух атомов водорода в дыхательную цепь.
Цикл глиоксилата, являющийся укороченным вариантом цикла ТКК, обнаруженным первоначально у бактерий, встречается также и у грибов, как у дрожжевых, так и у гифообразующих. Этапы обмена по глиоксилатиому пути состоят в следующем (см. рис. 3.7).
Под влиянием фермента изоцитратазы, при одновременном участии коэизима А, происходит расщепление изолимонной кислоты на сукдинил — КоА и глиоксилевую кислоту, содержащую сочетание карбоксильной и спиртовой групп, удобное для процессов конденсации. Сукцинил-КоА трансформируется далее по ходу цикла ТКК в сукцинат и фумарат, а глиоксилат конденсируется с помощью фермента малатсинтетазы с ацетил-КоА, что приводит к образованию яблочной кислоты. При этом отпадает необходимость в прохождении трех этапов цикла ТКК от изоцитрата до сукци — нил-КоА и источник для образования аспарагиновой кислоты в форме малата пополняется сразу двумя путями: через путь сукцинат— фумарат—малат и через конденсацию глиоксилата с аце — тил-КоА. Кроме того, возможен третий путь через восстановление оксалацетата.
Все это приводит к быстрому накоплению обильного материала для биосинтеза аспарагиновой кислоты, получающейся путем ами — нирования малата или оксалацетата и вовлекающейся далее в биосинтез белков. Значение метаболизма в пределах цикла Кребса для грибов так же, как и в случае других живых организмов, сводится к трем основным функциям.
1. Синтез «материнских», или первичных, аминокислот путем аминирования кето — и оксикислот, на основе которых далее синтезируются белки. Главнейшие из этих путей аминирования состоят в трансформациях: оксалацетат (или малат)-аспарагиновая кислота, а-кетоглутарат — глутаминовая кислота и, на пороге цикла ТКК и гликолиза, пируват—аланин, а также глиоксилат—глицин.
2. Получение энергии и реализация окислительного фосфори — лирования в дыхательной цепи, т. е. процесса запасания энергии. Эта функция выполняется благодаря пятикратному сбрасыванию 2Н+ в процессе окисления кислот цикла Кребса. Запас энергии накапливается при этом в форме АТФ или других макроэрги — ческих соединений и служит источником снабжения энергией всевозможных синтезов.
3. Звено цикла ТКК, в котором осуществляется усвоение С02 при образовании щавелевоуксусной кислоты, так же, как и включение СОг в ацетат при образовании малоната (в жировом обмене), может служить для пополнения в клетке запаса углерода, используемого в различных биосинтезах.
